
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ B. Вычислить рН 0,05 М водного раствора хлорноватистой кислоты (HOCl)
|
|
|
|
Тогда
Вычислить рН 0,05 М водного раствора хлорноватистой кислоты (HOCl).
РН 0,2 М КОН равно 13,3.
УРОВЕНЬ В
ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ
1. Вычислить рН следующих водных растворов:
а) 0,02 М HCl,
б) 0,2 М KOH.
| Дано: c HCl = 0,02 М c KOH = 0,2 М | Решение
а) HCl = H+ + Cl-
рН = -lg c  ; ;
|
| pH –? |
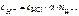
HCl – сильный электролит, α = 1,
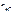 – число Н+, образовавшихся при диссоциации одной молекулы НСl,
– число Н+, образовавшихся при диссоциации одной молекулы НСl,
n  = 1, тогда
= 1, тогда 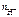 = c
= c 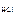 = 0,02 моль/л = 2 · 10-2 моль/л.
= 0,02 моль/л = 2 · 10-2 моль/л.
рН = -lg2·10-2 = -lg2 + (-lg10-2)= – 0,3 + 2 = 1,7.
б) KOH = К+ + ОН-;
рН = 14 – рОН; рОН = -lg c  ,
,
c  = c
= c  · α · n
· α · n 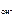 ,
,
КОН – сильный электролит, α = 1,
n 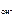 – число ОН-, образовавшихся при диссоциации одной молекулы КОН, n
– число ОН-, образовавшихся при диссоциации одной молекулы КОН, n 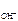 = 1, тогда c
= 1, тогда c 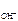 = c KOH = 2·10-1 моль/л,
= c KOH = 2·10-1 моль/л,
рОН = –lg(2·10-1) = –lg2 + (–lg10-1) = – 0,3 + 1 = 0,7.
рН = 14 – 0,7 = 13,3.
Ответ: рН 0,02 М HCl равно 1,7;
Дано:
c  = 0,05 М = 0,05 М
| Решение
HOCl <=> H+ + OCl-
HOCl – слабый электролит.
рН = –lg[H+]; [H+] = c НOСl·α· n 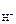 , ,
|
| pH –? |
n 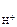 – число Н+ образовавшихся при диссоциации одной молекулы HOCl, n
– число Н+ образовавшихся при диссоциации одной молекулы HOCl, n 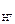 = 1.
= 1.
 ;
;
КHOCl – константа диссоциации HOCl:
К  = 5,0·10-8 (таблица),
= 5,0·10-8 (таблица),

c 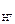 = 5·10-2 · 10-3 · 1 = 5,0 · 10-5 моль/л,
= 5·10-2 · 10-3 · 1 = 5,0 · 10-5 моль/л,
тогда рН = – lg5,0·10-5 = (-lg 5) + (-lg10-5) = – 0,7 + 5 = 4,3.
Ответ: рН 0,05 М HOCl равно 4,3.
3. Определить произведение растворимости MgF2, если его растворимость в воде при 25 ºС равна 1,17·10-3 моль/л.
Дано:
c 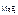 = 1,17·10-3 моль/л = 1,17·10-3 моль/л
| Решение Равновесие между осадком малорастворимого электролита и насыщенным раствором над ним выражается уравнением |
ПР  –? –?
|
MgF2(к) <=> Mg2+ (р) + 2F-(р),
ПР  = [Mg2+ ]·[F-]2,
= [Mg2+ ]·[F-]2,
[Mg2+ ] = c 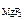 ·α· n
·α· n  , [F-] = c
, [F-] = c  ·α· n
·α· n 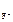 .
.
MgF2 – сильный электролит, α = 1;
n 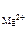 = 1, n
= 1, n  = 2 (из приведенного уравнения)
= 2 (из приведенного уравнения)
[Mg2+ ] = 1,17·10-3·1·1 = 1,17·10-3 моль/л;
[F-] = 1,17·10-3·1·2 = 2,34·10-3 моль/л.
Тогда ПР  = 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
= 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
Ответ: ПР  = 6,41·10-9.
= 6,41·10-9.
8. ГИДРОЛИЗ СОЛЕЙ
1.Написать ионно-молекулярные и молекулярные уравнения гидролиза солей:
а) сульфата хрома (III),
б) сульфида натрия
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 636; Нарушение авторских прав?; Мы поможем в написании вашей работы!