
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость электродных потенциалов от концентрации. Уравнение Нернста. Расчет Энергии Гиббса окисл-восст процессов по ЭДС гальванического эл-та
|
|
|
|
Билет 13 (в шпорах нет)
Произведение растворимости Условия образования и ратсворения осадков. Ионный обмен и ионообменники.
Насыщенный раствор образуется в том случае, когда растворяемое вещ-во больше уже не может растворяться в нем.Если растворяемое вещ-во представляет собой ионное соединение, то ионы в насыщенном растворе находятся в динамическом равновесии с избыточным, нерастворившимся тв вещ-вом. Например, в насыщенном растворе хлорида серебра устанавливается следующее равновесие: AgCl(тв)=Ag+(водн)+Cl-(водн)
Константа этого равновесия определяется выражением: Kпр=([Ag+][Cl-])равн
K-произведение растворимости хлорида серебра.Растворимость хлорида серебра можно выразить через концентрацию с растворенного AgCl в воде.Эта концентрация совпадает с конц обоих ионов в растворe [Ag]=[Cl]=c
Кпр=с 2
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре.Эта величина количественно характеризует способность электролита растворяться.
Условие образования и растворения осадков: произведение растворимостей могут использоваться для предсказания условий осаждения солей из раствора.Если произведение концентраций ионов в двух смешиваемых растворах превосходит произведение растворимости, то после смешивания раствора будет происходить осаждение осадка, до тех пор, пока произведение концентраций ионов не станет меньше произведения растворимости.
Ионный обмен-это процесс, в результате которого ионы, находящиеся в твердой фазе,обмениваются с ионами, находящимися в растворе.
Ионообменники: катионообменники, анионообменники.Когда твердый катионообменник приходит в соприкосновение с раствором, в котором содержатся какие-либо ионы, между ними устанавливается равновесие.
Ионный материал можно регенерировать(восстанавливать)
Анионообменник удаляет из раствора анионы.Для регенерации анионообменника может использоваться какое-либо основание.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо, что приводит к отрицательному заряду на металле по отношению к раствору. Если малоактивный металл погружен в раствор соли с концентрацией больше равновесной, то происходит переход ионов из раствора на металл, заряженный положительно. В любом случае возникает двойной электрический слой, и появляется разность электрических потенциалов, или гальвани-потенциал.
Зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал (Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh) — мера способности химического вещества присоединять электроны (восстанавливаться)). Окислительно-восстановительный потенциал выражают в милливольтах (мВ) системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
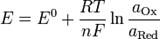
E — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
R— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T — абсолютная температура;
F— число Фарадея, равное 96485,35 Кл/моль;
m— число моль электронов, участвующих в процессе;
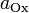 и
и 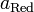 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔGo должна быть отрицательной, в соответствии со следующим уравнением:
ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 2118; Нарушение авторских прав?; Мы поможем в написании вашей работы!