
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория Бренстеда-Лоури (протонная теория, теория сопряженных кислот-оснований
|
|
|
|
Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
Теория Аррениуса: Кислоты - электролиты, при дисс-ции (ионизации) к-ых образуются катионы водорода (протоны) и анионы кис-го остатка. HnK = nH+ + Kn- Примеры: HCl = H+ + Cl-
Важно: Следует отметить, что многоосновные кислоты диссоциируют ступенчато!
Основания - электролиты, при диссоциации которых образуются катионы металла (или аммония) и гидроксид-анионы. Me(OH)n = Men+ + nOH- Примеры: NaOH = Na+ + OH- Важно: Многокислотные основания так же как многоосновные кислоты диссоциируют ступечато!
Вывод: согласно теории Аррениуса кислотные свойства обусловлены отдачей молекулой вещества протонов, а основные свойства отдачей гидроксо-анионов. Взаимодействие кислоты и основания при этом сводится к связывании протонов и гидроксо-анионов в молекулы воды. H+ + OH- = H2O
Кислоты - вещества, способные отщеплять протоны. Основания - вещества, способные принимать протоны.
При взаимодействии кислоты и основания, кислота отдаёт свои протоны, а основание их принимает (связывает). При этом кислота переходит в сопряжённое её основание (более слабое), а основание переходит в сопряжённую ему кислоту (более слабую).
Кислота + Основание = Сопряжённая кислота + Сопряжённое основание
HCl + H2O = H3O + Cl-
кис-та основание сопряж. кис-та сопряж. основание
Теория Льюиса (Электронная Теория Кислот-Оснований) Кислота - вещество, способное принять электронную пару с образованием ковалентной связи (акцептор неподелённой электронной пары, кислота Льюиса). Основание - вещество, способное предоставить электронную пару для образования ковалентной связи (донор неподелённой электронной пары, основание Льюиса).
Взаим-ие кислоты с основанием сводится к перераспределению между ними электронных пар.
К примеру протон является кислотой, поскольку ему не хватает электронов и требуется электронная пара для образования устойчивой электронной оболочки.
Аммиак является основанием, так как на атоме азота имеется неподелённая электронная пара.
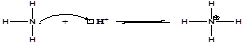
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 412; Нарушение авторских прав?; Мы поможем в написании вашей работы!