
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные свойства растворов. Законы Генри, Рауля, Вант-Гоффа
|
|
|
|
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). Растворение похоже на хим. реакцию, но состав раствора может изменится в широких пределах. Кроме того, в свойствах растворов обнаруживаются свойства отдельных компонентов. Таким образом, раствор занимает промежуточную стадию между хим. соед. и механическими смесями. Классификация по степени дисперсности: истинные растворы (системы с молекулярной или ионной дисперсностью. Гомогенные системы) (D≤10А0), коллоидные растворы(D≤1000А0), грубодисперсные системы(D≥1000А0).
Способы количественного выражения состава растворов: приблизительные (концентр.раствор, разбавленный, ненасыщенный, пересыщенный).Точные: 1. Массовая доля: отношение массы растворённого вещества к массе раствора. 2. Объёмная доля φ=Vв-ва/Vр-ра.3. Мольная (молярная) доля χ=υв-ва/Σ υр-ра*100 % отношение кол-ва растворённого вещ-ва к сумме кол-в всех веществ составляющих раствор. 4. Массовая концентрация. CМАСС=mв-ва/Vр-ра. (CМАСС= Смол*M) 5. Молярная концентрация Смол = υв-ва/ Vр-ра. 6. Молярная концентрация эквивалента (нормальная) Снорм= υЭв-ва/ Vр-ра , Снорм= Смол/z.7.Моляльность Смоляльн= υв-ва/ mрастворителя
Коллигативные свойства растворов — это те их свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
Закон Ван- Гоффа π=CRT, где π – осмотическое давление.
Закон Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества. (Po-P)/Po=N.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора.
Δtкип=Ккип*m*1000/Mg=Kкип*Смоляльн, Δtзам=Кзам*m*1000/Mg=Kзам*Смоляльн
Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон описан английским химиком У. Генри в 1803 г.
Закон Генри записывается обычно следующим образом:

где:
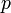 — парциальное давление газа над раствором,
— парциальное давление газа над раствором,
 — концентрация газа в растворе в долях моля,
— концентрация газа в растворе в долях моля,
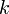 — коэффициент Генри.
— коэффициент Генри.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 732; Нарушение авторских прав?; Мы поможем в написании вашей работы!