
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полярная и неполярная ковалентная связь. Степень ионности и ковалентности связи. Природа связи в комплексных соединениях
|
|
|
|
Билет №22
Самая распространенная в органических и неорганических соединениях – ковалентная связь.
Ковалентная связь делится на полярную (HCl, H2O) и неполярную (H2, O2).
Способы описания ковалентной связи:
1) Метод валентных связей (МВС) позволяет рассмотреть механизмы связи, ее тип, хар-р.
2) Метод отталкивания валентных электронных пар (МОВЭП) предсказывает геометрию молекулы.
3) Метод молекулярных орбиталей (ММО) позволяет рассмотреть процесс образования хим. Связи с энергетической точки зрения.
Ковалентная связь с точки зрения МВС. Фор-ла Льюиса.
Ковалентная связь – химическая связь, которая образуется между двумя атомами за счет обобществления пары электронов по одной от каждого атома.
Пары электронов локализованы в пространстве между двумя атомами, причем электроны имеют антипараллельные спины.
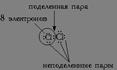 Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании.
Льюис не только предложил теорию ковалентной связи, но и первым сформулировал правило октета. Это правило применительно к химическим связям можно сформулировать так:
атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов.
Механизмы образования ковалентной связи:
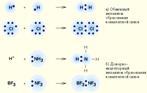
1) Обменный механизм – механизм, при котором каждый атом отдает по одному неспаренному электрону.
2) Донорно-акцепторный – механизм, при котором один атом (донор) предоставляет пару электронов, а другой атом (акцептор) предоставляет вакантную орбиталь.
Обменный. Химическая связь, образованная за счет перекрывания атомных орбиталей вдоль оси связывающих ядра атомов называется сигма-связью.
пи-связь – химическая связь, образованная за счет бокового перекрывания атомных орбиталей по обе стороны
Т.к. боковое перекрывание энергетически менее выгодно, то пи-связь легче разрывается, значит более реакционно-способны.
Донорно-акцепторный.
Хар-ки ковал. св
1) Длина – минимальное равновесное состояние между ядрами двух взаимодействующих атомов. Чем связь короче, чем меньше ее длина, тем она прочнее.
2) Энергия – та работа, которую надо совершить, чтобы эту связь разорвать.
3) Кратность – число локализованных электронных пар между двумя взаимодействующими атомами. С увеличением кратности длина связи уменьшается, а прочность растет.
4) Полярность – (не)симметричное распределение электронной плотности относительно двух атомов. (полярные атомы – несимм, неполяр – симметрич)
5) Электронный момент диполя m – чем больше m, тем связь полярнее. Говорит о полярности связи и о ее геометрии. Ковал св может быть полярной, а молекула в целом – неполярна, поскольку геометрическая сумма находится как электронная сумма векторов молекул св. СО2 – линейная (m=0), а SO2 – угловая (m≠0).
6) Эффективные заряды атомов – частичные заряды, которые приобретают атомы при образовании ковал полярной св.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 518; Нарушение авторских прав?; Мы поможем в написании вашей работы!