
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесия. Виды равновесий. Стабильное и метаболическое равновесие. Равновесие статистическое и динамическое
|
|
|
|
Свойства химической связи
1) Насыщенность. Определяется числом валентных электронов е, предоставляемых каждым атомом на образование св.
Валентность – способность атомов к образованию хим св. – число неспаренных электронов или максимальной валентностью атома электрона.
2) Направленность. Определяет пространственную геометрию молекулы, поскольку орбитали p,d,f-типа имеют определенное положение в пространстве. Только s-орбитали имеют сферическую симметрию и образуют одинак св по прочности во всех направлениях.
2!Степень ионности/ковалентности св – величина заряда в % от степени заряда электрона е, которую приобретают атомы в процессе образования связи.
По правилу Фаянса, степень ковалентности велика в случае большого заряда на ионах, малого размера катиона и большого размера аниона.
Чем больше разность ЭО, тем больше доля ионного характера, или степень ионности связи. Разность ЭО, равная 2,1, соответствует приблизительно 50%-ному ионному характеру. Связи с разностью ЭО больше 2,1 могут считаться ионными. Связи с меньшей разностью ЭО относят к полярным ковалентным связям. Чем меньше разность ЭО, тем меньше степень ионности связи. Нулевая разность ЭО указывает на отсутствие ионного характера и, следовательно, на чисто ковалентную связь.
Природа связи в комплексных соединениях. Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой — между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счет неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Р авновесие – состояние системы, при котором все внешние воздействия уравновешены.
Равновесие:Виды!
1) Статистическое ® механическое равновесие
2) Динамическое ®физические – не происходит превращения в-в (лед-жидкость-пар)
®химические – реагенты превращаются в продукты, а продукты – в реагенты, т.е. идут два одновременно противоположных процесса с одинаковой скоростью.
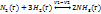
Хим равновесие – обратимый процесс, при котором концентрация реагентов уменьшается, а концентрация продуктов возрастает, при этом исходные вещества не расходуются до конца.
Равновесные концентрации – те концентрации реагентов и продуктов, которые устанавливаются к моменту равновесия.
Константа равновесия – отношение произведения равновесных концентраций продуктов к произведению равновесных концентраций реагентов в степенях равных стехиометрическим коэффициентов.
Константа равновесия показывает полноту превращения (хар-ет количественно выход продукта). Она не зависит от концентр и катализатора.
СТАБИЛЬНОЕ РАВНОВЕСИЕ — точка равновесия, в которую всегда возвращается система после того, как она была из нее выведена.
Фазовые равновесия могут быть стабильными и метастабильными. Те и другие являются локально устойчивыми, то есть устойчивыми по отношению к малым возмущениям параметров состояния - температуры, давления, состава (концентраций компонентов). Метастабильные фазовые равновесия отличаются тем, что они неустойчивы к некоторым конечным изменениям этих параметров, ведущим, в частности, к переходу к другим фазам.
Следует отметить нек-рые особенности метастабильных фаз: при одной и той же т-ре давление пара выше над метастабильной фазой, чем над стабильной; при одном и том же давлении т-ра плавления метастабильной фазы ниже, чем стабильной; растворимость метастабильной фазы при постоянных давлении и т-ре выше, чем стабильной. Последнее справедливо как для жидких, так и для твердых р-ров.
Стабильное равновесие характеризуется абсолютным минимумом соответствующих характеристических функций. При таком равновесии всякое достаточно малое воздействие вызывает какое-либо малое изменение состояния системы, причем перемена направления воздействия вызывает перемену направления изменения состояния системы, а будучи выведенной из состояния равновесия, система сама возвращается в него после прекращения воздействия на нее. Таким образом, стабильное равновесие может быть достигнуто как бы с разных сторон.
Метастабильное равновесие характеризуется относительным минимумом соответствующих характеристик функции. В этом случае воздействие на систему может привести к конечным изменениям в направлении стабильного равновесия, некоторые бесконечно малые воздействия вызывают настоль малые изменения системы, что изменение направления воздействия обусловливает перемену направления происходящего изменения, а следовательно, система будет возвращаться в исходное состояние после прекращения этих воздействий.
Равновесие статистическое, состояние замкнутой статистической системы, в которой среднее значения всех физических величин, характеризующих состояние, не зависят от времени. Р. с. — одно из основных понятий статистической физики, играющее такую же роль, как равновесие термодинамическое в термодинамике. Р. с. не является равновесным в механическом смысле, т.к. в системе при этом не прекращаются малые отклонения.
Динамическое равновесие устанавливается, когда оказываются сбалансированными два обратимых или противоположных процесса. Примером механического динамического равновесия может служить человек, идущий по эскалатору в сторону, противоположную движению эскалатора, со скоростью, равной скорости эскалатора. В этом случае результирующее положение человека не изменяется, потому что оба противоположно направленных движения сбалансированы.
Динамические равновесия можно подразделить на физические и химические равновесия.
Физических равновесия. Динамическую природу фазовых равновесий можно понять, рассматривая их в свете кинетической теории. Рассмотрим, например, равновесие между жидкостью и ее паром (рис. 6.3). В этом случае обе фазы находятся в динамическом равновесии, если скорость испарения жидкости равна скорости конденсации пара. Другими словами, в каждый промежуток времени число частиц, покидающих жидкость, равно числу частиц, возвращающихся в нее.
Система находится в состоянии химического равновесия, если скорость прямой реакции равна скорости обратной реакции. Например, если скорость протекания реакции
N2 (г.) + 3H2 (г.) = 2NH3 (г.)
равна скорости обратной реакции 2NH3(r.) = N2(r.) + 3H2 (г.)

то система находится в динамическом равновесии. Подобные реакции называются обратимыми, а их уравнения записываются с помощью двойной стрелки:
N2(r.) + 3H2 (г.) = 2NH3 (г.)
+принципы Ле-Шателье.
Динамические равновесия независимо от того, физические они или химические, характеризуются целым рядом общих свойств:
- они включают прямой и обратный процессы;
- прямой и обратный процессы сбалансированы между собой;
- общие свойства системы, находящиеся в динамическом равновесии, постоянны;
- состояние равновесия может быть достигнуто как со стороны прямого процесса, так и со стороны обратного процесса;
- динамическое равновесие может устанавливаться только в замкнутой системе.
Замкнутой системой называется такая система, которая не обменивается со своим окружением веществом. Так, если в приведенном выше примере с аммиаком происходит утечка аммиака из реакционной системы, то реакция не может достичь состояния равновесия.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 1608; Нарушение авторских прав?; Мы поможем в написании вашей работы!