
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции в растворах электролитов.гидролиз солей. Жесткость воды. 1.электрическая диссоциация-это обратимый процесс распада молекул электролита на противоположно заряженные ионы
|
|
|
|
1. электрическая диссоциация-это обратимый процесс распада молекул электролита на противоположно заряженные ионы, под влиянием полярных молекул воды (растворителя) или под действием высоких температур.
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды.
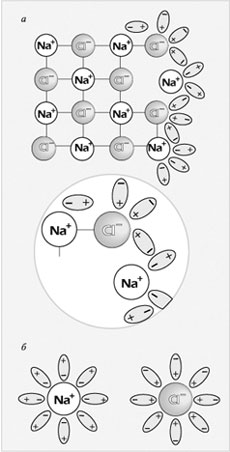
Рис. 2.
Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na+;
б – гидратация (окружение молекулами воды) ионов Na+ и Сl–
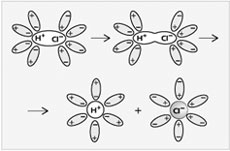 Рис. 3.
Рис. 3.
Диссоциация молекул HCl
на ионы в водном растворе
количественная характеристика процесса диссоциации является степень диссоциации
(α=n/N *100%) она представляет собой отношение n- количество молекул распавшихся на ионы к общему числу растворенных молекул N в процентах.
Α зависит от:
1) природы растворенного вещества(ионные в >й степени, чем ковалентные полярные)
2) от зарядов ионов NaCl=(обратим.) Na++Cl- α=90%
3) от to
4) от концентрации (чем выше конц-ия, тем ниже α)
Диссоциация различных классов соединений
Кислоты( с точки зрения электролитической диссоциации ) -это электролиты при диссоциации которых в качестве катионов образуются только катионы водорода.
HCl=(обратим.)H++Cl-
H3PO4=(обратим.)H++H2PO4 H2PO4=(обратим.)H++HPO42-
Одноосновные в 1 ступень, многоосновные в несколько.
Основания- это электролиты при диссоциации которых в качестве анионов образуются только анионы гидроксо группы
Одноосновные в одну, многоосновные в несколько.
KOH=(обратим.)K++OH-
Ca(OH)2=(обратим.) (CaOH)++OH-
CaOH+=(обратим.)Ca2++OH-
α1>α 2
соли- растворимые соли считаются сильными электролитами, нерастворимые-слыбыми.
Средние соли диссоциируют в 1ну ступень
AL2(SO4)3=(обратим.) 2AL3++3SO42-
Кислые соли диссоциируют ступенчато
NaHCO3 =(обратим.) Na++HCO3
HCO3 =(обратим.) H++ CO32-
α1>α 2
Основные соли слабые электролины.
CuOHNO=(обратим.)CuOH++NO3-
CuOH+=(обратим.)Cu2++OH-
Комплекстыные соли диссоциируют на ионы внешней и внутренней сферы
Na2[Zn(OH)4] =(обратим.)2Na++[Zn(OH)4]2-
AB=(обратим.)A++B-
Kp=[A+]*[ B-]/[AB]
Kp – не зависит от концетрации,зависит от природы вещества и to
2. Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН.
Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр:
pH=-lg[ H+ ]
Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Индикаторы - это специальные реактивы, которые изменяют свою окраску в зависимости от кислотности среды.
Индикаторы -слабые органические кислоты или слабые органические основания.
Наиб. Распрост. – лакмус, метилорандж, фенолфтолеин.
Лакмус-это слаб. орг. кис-та
В кислоте красная(равновесие смещается в сторону обратной реакции), в щелочи синяя(по принципу ла-шателье в сторону прямой), в нейтральной среде-фиолетовая.
3. Гидролиз -это обратимый процесс взаимодействия ионов соли с составными частями молекул воды с образованием слабого электролита и с изменением Ph среды.
Движущая сила гидролиза- образование слабого электролита.
4. Правило написания ур-ия гидролиза:
1Написать диссоциацию соли
2Определить каким электролитов по силе была образована данная соль и опр. Ион слабого электролита
3написать реакцию иона слабого электролина с 1й молекулой воды
4определить реакцию среды
PH<7 кислая
5написать молекулярное ур-ие гидролиза(для этого к ионам кратного ур-ия нужно добавить тот ион, который в гидролизе не участвовал)
5. потому что большинство реакций гидролиза останавливается на первой стадии
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 463; Нарушение авторских прав?; Мы поможем в написании вашей работы!