
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение основных термодинамических процессов идеального газа. Графики основных термодинамических процессов идеального газа в P-V и T-S диаграммах
|
|
|
|
Ответ:
Изменение состояния термодинамической системы во времени называется термодинамическим процессом.
Изохорный процесс - это процесс протекающий при постоянном объеме.
Из уравнения состояния идеального газа следует, что  , т.е. давление газа прямо пропорционально его абсолютной температуре:
, т.е. давление газа прямо пропорционально его абсолютной температуре:
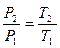

|
Работа расширения равна нулю, т.к. dv=0.
Количество теплоты, подведенной к рабочему телу в процессе 1 2 при cv=const, определяется из соотношений

При переменной теплоемкости
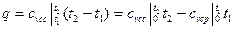
где 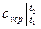 -средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
-средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
Т.к. l=0, то в соответствии с первым законом термодинамики 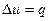 и
и
 при cv=const;
при cv=const;
 при сv=var.
при сv=var.
Поскольку внутренняя энергия идеального газа является функцией только его температуры, то формулы справедливы для любого термодинамического процесса идеального газа.
Изменение энтропии в изохорном процессе определяется по формуле:
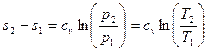 ,
,
т.е. зависимость энтропии от температуры на изохоре при cv=const имеет логарифмический характер.
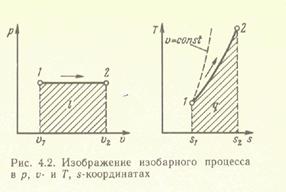
Изобарный процесс- это процесс, протекающий при постоянном давлении. Из уравнения состояния идеального газа следует, что при p=const находим 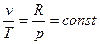 , или
, или
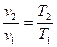 ,
,
т.е. в изобарном процессе объем газа пропорционален его абсолютной температуре. На рисунке изображен график процесса
Рис. Изображение изобарного процесса в p, v- и T, s-координатах
Из выражения следует, что 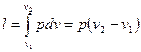 .
.
Так как 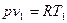 и
и 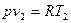 , то одновременно
, то одновременно  .
.
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения
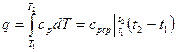 ,
,
 - средняя массовая изобарная теплоемкость в интервале температур от t1 до t2; при cp=const
- средняя массовая изобарная теплоемкость в интервале температур от t1 до t2; при cp=const  .
.
Изменение энтропии при cp=const согласно равно 
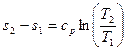 , т.е. температурная зависимость энтропии при изобарном процессе тоже имеет логарифмический характер, но поскольку сp>cv, то изобара в Т-S- диаграмме более полого, чем изохора.
, т.е. температурная зависимость энтропии при изобарном процессе тоже имеет логарифмический характер, но поскольку сp>cv, то изобара в Т-S- диаграмме более полого, чем изохора.
Изотермический процесс - это процесс, протекающий при постоянной температуре.  или
или 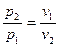 , т.е давление и объем обратно пропорциональны друг другу, так что при изетермическом сжатии давление газа возрастает, а при расширении падает.
, т.е давление и объем обратно пропорциональны друг другу, так что при изетермическом сжатии давление газа возрастает, а при расширении падает.
 Работа процесса
Работа процесса 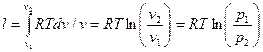
Так как температура не меняется то 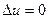 и вся подводимая теплота превращается в работу расширения q=l.
и вся подводимая теплота превращается в работу расширения q=l.
Изменение энтропии равно 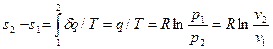
Адиабатный процесс. Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным, т. е. 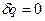 .
.
Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
Уравнения первого закона термодинамика для адиабатного процесса принимают вид: cpdT — vdp = 0; codT ' + pdv = 0. Поделив первое уравнение на второе, получим
 или
или 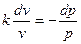
 После интегрирования получим
После интегрирования получим 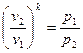 или
или  .
.
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const). Величина

называется показателем адиабаты. Подставив cp = cv+R, получим k=1+R/cv
Величина k также не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k =1,66, для двухатомного k = 1,4, для трех-и многоатомных газов k = 1,33.
Поскольку k > 1, то в координатах р, v (рис. 4.4) линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Определив из уравнения состояния, написанного для состояний 1 и 2, отношение объемов или давлений и подставив их, получим уравнение адиабатного процесса в форме, выражающей зависимость температуры от объема или давления
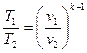 ,
, 
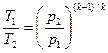
Любой процесс можно описать в p, v-координатах уравнением  подбирая соответствующее значение n. Процесс, описываемый этим уравнением, называется политропным.
подбирая соответствующее значение n. Процесс, описываемый этим уравнением, называется политропным.
 Для данного процесса n является величиной постоянной.
Для данного процесса n является величиной постоянной.
Из уравнений можно получить
 ,
,  ,
,  ,
,
На рис. 4.5 показано взаимное расположение на р, v- и Т, s-диаграммах политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
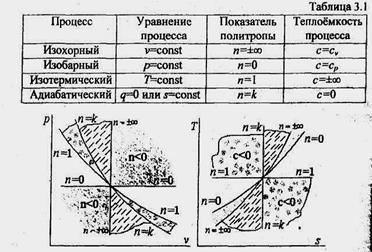
Изохора (n= ± оо) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой (n = 1), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, так как dq и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах |/|>|q!, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела
7.Какой процесс остается неизменным в адиабатном процессе и почему?
Адиабатный процесс -это процесс протекающий без теплообмена с окружающей средой 
Под энтропией тела можно понимать величину, изменения которой 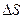 в любом элементарном термодинамическом процессе равно отношению внешнего тепла
в любом элементарном термодинамическом процессе равно отношению внешнего тепла  , участвующий в этом процессе, к абсолютной температуре тела
, участвующий в этом процессе, к абсолютной температуре тела  , dS=0, S=сonst
, dS=0, S=сonst
Энтропия –это термодинамический параметр системы, j характеризует степень порядка в системе.
Для адиабатного процесса, протекающего без теплообмена газа с внешней средой (dq=0)
S1=S2=S=const, т.к. в этом процессе q=0, то  , адиабатный процесс в T-S диаграмме изображается прямой линией.
, адиабатный процесс в T-S диаграмме изображается прямой линией.
 (является качественной характеристикой процесса преобразования).
(является качественной характеристикой процесса преобразования).
В уравнении абсолютная температура Т величина всегда положительная, тогда  и
и  имеют одинаковые знаки, т.е если
имеют одинаковые знаки, т.е если  положительно, то
положительно, то  положительно, и наоборот. Таким образом в обратимых процессах с подводом тепла (
положительно, и наоборот. Таким образом в обратимых процессах с подводом тепла ( >0) энтропия газа увеличивается, а в обратимых с отводом тепла уменьшается- это важное свойство параметра S.
>0) энтропия газа увеличивается, а в обратимых с отводом тепла уменьшается- это важное свойство параметра S.
Изменение энтропии зависит лишь от начального и конечного состояния рабочего тела.
8.Что такое энтальпия? Как изменяется энтальпия в процессе дросселирования идеального газа?
Энтальпия (теплосодержание, от греч. нагревать)
Энтальпия - это сумма внутренней энергии газа и потенциальной энергии, давления
обусловленное действием внешних сил.
I=U+PV,
где U-внутренняя энергия 1 кг газа.
PV-работа проталкивания, при этом Р и V соответственно давление и удельный объём при температуре, для которой определена внутренняя энергия.
Энтальпию измеряют в тех же единицах, что и внутреннюю энергию (кДж/кг или
ккал/кг).
Энтальпия идеального газа определяется следующим способом:
Так как входящие в нее величины являются функциям состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности Величина
h= u+pv,
называемая удельной энтальпией (h= Н/М), представляет собой энтальпию системы содержащей 1 кг вещества, и измеряется в Дж/кг.
Изменение энтальпии. в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Физический смысл энтальпии выясним на следующем примере. Рассмотрим
расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом в (рис. 2.4). Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: если давление системы сохраняется неизменным, т. е. осуществляется изобарный процесс (dp=0), то 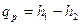
т. е. теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы.
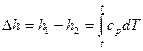

9.Первый закон термодинамики и его записи через внутреннюю энергию и энтальпию?
Первый закон термодинамики является приложением закона сохранения и превращения энергии к тепловым явлениям. Напомним, что сущность закона сохранения и превращения энергии, являющегося основным, законом естествознания, состоит в том, что энергия не создаётся из ничего и не исчезает бесследно, а превращается из одной формы в другую в строго определённых количествах. Энергия вообще - это свойство тел, при определённых условиях совершающее работу.
Под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами. Внутренняя энергия это функция состояния
Первый закон термодинамики: теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы
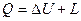 и
и 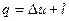
Первый закон термодинамики для энтальпии: 
l’-внешняя располагаемая работа –это работа совершаемая за пределами системы, с целью возврата системы в состояния равновесия
10.Записать формулу для расчета количества тепла, необходимого для нагрева М кг газа на  при постоянном давлении и объеме?
при постоянном давлении и объеме?
Теплоемкость системы- это количество теплоты необходимое для изменения температуры системы на единицу. 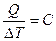
Теплоемкость- необходимое количество тепла, на нагрев 1кг на 10С
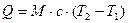 ,
,
где М-масса, кг
с-теплоемкость, кДж/кгК
ср-теплоемкость при при постоянном давлении (изобарная)=0,718 кДж/кгК
сv- теплоемкость при при постоянном объеме (изохорная)=1,005 кДж/кгК
Т-температура, 0С
11.Как определить среднюю в интервале температур t1 и t2 теплоемкость по табличным значениям от 00 до t10C и до t20C соответственно. Чему равна теплоемкость в адиабатическом процессе?
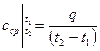 или
или 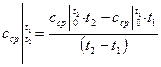
В адиабатном процессе теплоемкость равна 0, так как нет обмена с окружающей средой.
12.Соотношение между теплоемкостями идеального газа при Р=const и V= const. Чему равна теплоемкость кипящей воды?
Уравнение Майера  , для идеального газа
, для идеального газа
Для реального газа  ,
,
где R-газовая постоянная численно равная работе расширения одного кг газа в изобарных условиях при нагреве на 1 0С
В процессе v= сonst теплота, сообщаема газу, идет лишь на изменение его внутренней энергии, тогда при процессе р= сonst теплота расходуется на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше сv на величину этой работы.
k=cp/cv-показатель адиобаты
Кипение Т=const поэтому по определению теплоемкость кипящей воды бесконечность.
13. Дайте одну из формулировок 2-го закона термодинамики? Приведите его математическую запись.
2 закон термодинамики устанавливает качественную зависимость, т.е. определяет направление реальных тепловых процессов и условие преобразования теплоты в работах.
2 закон термодинамики: Теплота не может самостоятельно переходить от более холодного к более нагретому (без компенсации)
Для осуществления процесса перевода теплоты в работу необходимо иметь не только горячий источник, но и холодный, т.е. необходим температурный перепад.
1.Освальд: вечный двигатель второго рода невозможен.
2.Томсон: невозможно периодическое действие теплового двигателя единственным результатом работы которого было бы отнятие теплоты от некоторого источника
3.Клаузиус: невозможен самопроизвольный нескомпенсировнный переход тепла от тел с температурой к телам с более высокой темпертурой.
Математическая запись 2-го рода для обратных процессов:  или
или 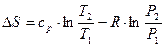
Математическая запись 2-го рода для необратимых процессов: 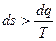
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 9399; Нарушение авторских прав?; Мы поможем в написании вашей работы!