
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Распределение молекул идеального газа по скоростям и энергиям теплового движения
|
|
|
|
По МКТ, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой m0 в газе, находящимся в состоянии равновесия при Т=const, остаётся равной:

Это объясняется тем, что в газе устанавливается некоторое стационарное распределение молекул по скоростям, которое подчиняется закону Максвелла.
Закон Максвелла описывается некоторой функцией 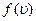 , называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на равные малые интервалы
, называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на равные малые интервалы 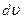 , то на каждый интервал скорости будет приходиться некоторое число молекул
, то на каждый интервал скорости будет приходиться некоторое число молекул  , имеющих скорость, заключённую в этом интервале. Функция
, имеющих скорость, заключённую в этом интервале. Функция 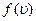 определяет относительное число молекул,
определяет относительное число молекул,  , скорости которых лежат в интервале
, скорости которых лежат в интервале 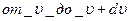 , т.е.:
, т.е.:

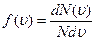 .
.
Применяя методы теории вероятностей Максвелл нашёл функцию 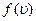 - закон для распределения молекул идеального газа по скоростям:
- закон для распределения молекул идеального газа по скоростям:
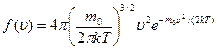 (*)
(*)
Из этого видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состоянии (от температуры Т).

Т.к. при возрастании 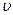 множитель
множитель 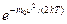 уменьшается быстрее, чем растёт множитель
уменьшается быстрее, чем растёт множитель  , тот функция
, тот функция 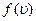 , начиная от нуля достигает максимума при
, начиная от нуля достигает максимума при  и затем асимптотически стремится к 0. Кривая не симметрична относительно
и затем асимптотически стремится к 0. Кривая не симметрична относительно  .
.
Относительное число молекул  находится, как площадь более зелёной плоскости на рисунке. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция удовлетворяет условию нормировки.
находится, как площадь более зелёной плоскости на рисунке. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция удовлетворяет условию нормировки.
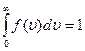
Наиболее вероятная скорость – скорость, при которой функция распределения молекул идеального газа по скоростям максимальна.
Значение наиболее вероятной скорости можно найти продифференцировав выражение (*) по аргументу 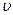 , приравняв результат 0 и используя условие для максимума выражения
, приравняв результат 0 и используя условие для максимума выражения 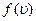 :
:
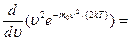
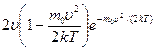

Значения  и 0 соответствуют минимумам выражения (*), а значение
и 0 соответствуют минимумам выражения (*), а значение 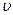 , при котором значение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость
, при котором значение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость 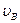 :
:

Из этой формулы следует, что при повышении Т максимум функции стремится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой остаётся неизменной, поэтому кривая будет растягиваться и понижаться.
Средняя скорость молекулы  (средняя арифметическая скорость) определяется по формуле:
(средняя арифметическая скорость) определяется по формуле:
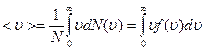 ,
,
подставляя сюда 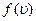 и интегрируя получим:
и интегрируя получим:
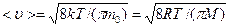
Скорости характеризующие состояние газа:
1) Наиболее вероятная: 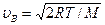
2) средняя: 
3) средняя квадратичная: 
Исходя из распределения молекул по скоростям
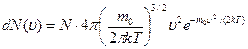
Можно найти распределение молекул газа по значениям кинетической энергии 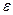 .
.
Учтя, что 
 получим:
получим:
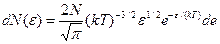
 ,
,
где 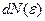 - число молекул, имеющих кинетическую энергию в интервале от
- число молекул, имеющих кинетическую энергию в интервале от 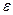 до
до  .
.
Функция распределения молекул по энергиям теплового движения
 .
.
Средняя кинетическая энергия  молекулы идеального газа
молекулы идеального газа

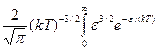
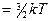 .
.
41. Барометрическая формула. Распределение Больцмана. 
Молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул – с друугой, приводят к некоторому стационирному состоянию газа, при котором давление газа с высотой убывает.
Выведем закон изменения давления с высотой, предполагая, что поле тяготения однородно,температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте h равно p, то на высоте  оно равно
оно равно  , значит:
, значит:
 , где
, где 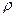 - плотность газа на высоте h. Следовательно,
- плотность газа на высоте h. Следовательно,
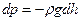 .(*)
.(*)
Воспользумся уравнением состояния ид. газа  ,
,

находим, что  . Подставив это выражение в (*) получим:
. Подставив это выражение в (*) получим:
 , или
, или 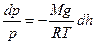 .
.
С изменением высоты от 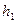 до
до 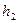 давление изменяется от
давление изменяется от 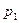 до
до  т.е.
т.е.  ,
, 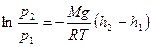 , или
, или
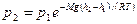 .
.
Это выражение называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление найти высоту. Этоже выражение может быть записано относительно уровня моря:
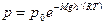 , где p-давление на высоте h. Прибор для определения высоты над земной поверхностью называется высотомером ( или альтиметром). Давление с высотой убывает тем быстрее, чем тяжелее газ.
, где p-давление на высоте h. Прибор для определения высоты над земной поверхностью называется высотомером ( или альтиметром). Давление с высотой убывает тем быстрее, чем тяжелее газ.
Эту арометрическубю формулу можно преобразовать, если воспользоваться выражением  :
:
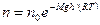 , где
, где 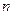 -концентрация молекул на высоте
-концентрация молекул на высоте 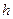 ,
, 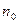 - то же на высоте
- то же на высоте  =0. Так как
=0. Так как  , а
, а  , то
, то
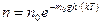 , где
, где 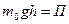 - потенциальная энергия молекулы в поле тяготения, т.е.
- потенциальная энергия молекулы в поле тяготения, т.е.
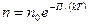 .
.
Это выражение называется распределением Больцмана во внешнем потенциальном поле. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул. Если частицы имеют одинаковую массу и находятся в состоянии хаотического движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
42. Средняя длина свободного пробега молекул.
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя столкновениями молекулы проходят некоторый путь  , который называется длиной свободного пробега. Т.к. мы имеем дело с большим числом молекул, то можно говорить о средней длине свободного пробега молекул
, который называется длиной свободного пробега. Т.к. мы имеем дело с большим числом молекул, то можно говорить о средней длине свободного пробега молекул  . Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы
. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы 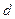 . Он зависит от скорости сталкивающихся молекул, т.е. от темпратуры газа.
. Он зависит от скорости сталкивающихся молекул, т.е. от темпратуры газа.
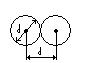
Так как за 1с молекула проходит в среднем путь, равный средней арифметической скорости  , и если
, и если 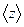 - среднее число столкновений, испытываемых молекулой газа за 1с, то средняя длина свбодного пробега:
- среднее число столкновений, испытываемых молекулой газа за 1с, то средняя длина свбодного пробега:
 .
. 
Для определения 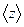 : молекула столкнётся только с теми «застывшими» молекулами, центры которых находятся на расстояниях равных или меньших
: молекула столкнётся только с теми «застывшими» молекулами, центры которых находятся на расстояниях равных или меньших 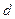 , т.е. лежат внутри «ломаного» цилиндра радиусом
, т.е. лежат внутри «ломаного» цилиндра радиусом 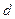 .
.
Среднее число столкновений за 1с равно числу молекул в объёме «ломаного» цилиндра:
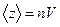 , где
, где 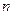 -концентрация молекул;
-концентрация молекул; 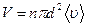 . Таким образом, среднее число столкновений:
. Таким образом, среднее число столкновений:
 .
.
Расчёты показывают, что при учёте движения других молекул:
 .
.
Тогда средняя длина свободного пробега:
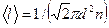 , т.е.
, т.е.  обратно пропорциональна концентрации
обратно пропорциональна концентрации 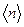 молекул. С другой стороны, из
молекул. С другой стороны, из  следует, что при постоянной температуре
следует, что при постоянной температуре 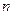 пропорциональна давлению
пропорциональна давлению  . Следовательно,
. Следовательно, 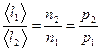 .
.
43. Явление переноса в термодинамически неравновесных системах. Теплопроводность. Диффузия. Внутреннее трение (вязкость).
В термодинамически неравновесных сисмах возникают особые необратимые процессы, называеьые явлениями переноса, в результате которых происходит пространственный перенос энергии, массы, импульса. К явлениям переноса относятся теплоёмкость, диффузия и внутреннее трение ( перенос импульса).
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 903; Нарушение авторских прав?; Мы поможем в написании вашей работы!