
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сокращение движущихся масштабов
|
|
|
|
Рассмотрим две СО, движущиеся друг относительно друга вдоль оси X. Пусть стержень, сориентированный вдоль этой оси, покоится относительно системы S'. Длина стержня в этой системе, называемой собственной системой отсчета (ССО), равна L0 и он перемещается слева направо со скоростью V относительно наблюдателя, находящегося в системе S. За длину движущегося стержня L примем разность координат концов стержня, зафиксированную в один момент времени по часам системы, в которой находится наблюдатель, т.е.
L = x2 - x1, если t1 = t2.
Воспользовавшись преобразованиями Лоренца, найдем связь между длинами стержня в разных СО.
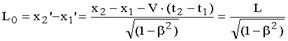

Из последней формулы видно, что:
длина движущегося стержня всегда меньше длины покоящегося стержня;
длина стержня максимальна в ССО;
длина движущегося стержня неограниченно уменьшается по мере приближения его скорости к скорости света.
27. Следствия из преобразований Лоренца. Замедление хода движущихся часов.
Пусть в движущейся СО происходит событие длительностью t0.
t0 = t'2 - t'1,
где t'1 и t'2 - время начала и конца события по часам системы X'Y'.
Точка, в которой происходит событие покоится относительно S'. В СО S начало и конец события будут происходить в разных точках x1 и x2 в другие моменты времени t1 и t2. Исходя из преобразований временных координат, найдем величину промежутка времени t между началом и концом события в системе S:

Из формулы видно, что:
длительность события, измеренного покоящимися относительно наблюдателя часами, всегда меньше длительности того же события, измеренного движущимися часами или темп движущихся часов замедлен по отношению к неподвижным;
отношение t0/t неограниченно уменьшается по мере приближения скорости движения СО к скорости света;
длительность события в некоторой точке пространства минимальна в собственной СО.
28. Следствия из преобразований Лоренца. Закон сложения скоростей:
Vx = dx / dt; dx = dx’ + vdt’ / корень… = dt’ (v’ + v) / корень…;
dt = (dt’ + dx’ v / c (ст.2)) / корень… = dt’ (1 + [v/c (ст.2)] *dx’/dt’) / корень…
vx =(vx’ + v) (корень 1 + v vx’ / c (ст.2))
vy = vy’ (корень…) / 1 + v vx’ / c (ст.2);vz=аналогично vy; x, y, z -индексы
Из этих соотношений видно, что в общем случае направление скоростей в k и k’ не совпадают.
29. Релятивистский импульс. Уравнение движения релятивистских частиц
Законы сохранения должны быть соблюдены во всех инерциальных системах отсчета, т.е. должны быть имвариантны по отношению к преобразованиям Лоренца. Если определить импульс тела как P = mv (как в Нбюоновской механике), то можно показать (рассмотрим например неуправляемые соударения частиц), что в релятивистском случае при определении P, закон сохранения не будет имвариантен по отношению к преобразованиям Лоренца. Можно показать, что закон сохранения импульса будет имвариантен по отношению к преобразованиям Лоренца, если определить импульс как P = m0 V / (корень 1 – V / c).
Величина m0 – масса покоя частиц. Если через m обозначить величину
m = m0 / корень…, то импульс частицы будет записан также как в Ньютоновской механике P = mV, где m – релятивистская масса частиц. Видно, что релятивистская масса частиц изменяется при изменениии скорости ее движения. Из 2х возможных (в Ньют. мех.) формулировок 2го закона Ньютона (F=ma; dP / dt = F) будет справедлива 2ая.
Второй закон будет иметь вид: (d/dt) * (m0 V / корень…) = F – основной закон в рел. механике. В релятивистском случае масса утрачивает пропорцианальность между силой и ускорением. В релятивистской механике сила и ускорение (в отличие от Ньютоновской механики) не являются имвариантными по отношению к преобразованиям Лоренца, т.е. изменяются при переходе от одной инерциальной системы отсчета к другой. Кроме этого сила F и ускорение a оказываются неколлинеарными.
30. 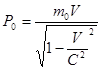
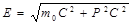

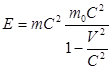

 - релятивистская масса тела.
- релятивистская масса тела.
31. Гармоническими колебаниями называются такие колебания, при которых колеблющаяся величина меняется от времени по закону синуса или косинуса.
Уравнение гармонических колебаний имеет вид:
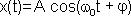 ,
,
где A - амплитуда колебаний (величина наибольшего отклонения системы от положения равновесия);  - круговая (циклическая) частота. Периодически изменяющийся аргумент косинуса
- круговая (циклическая) частота. Периодически изменяющийся аргумент косинуса 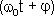 - называется фазой колебаний. Фаза колебаний определяет смещение колеблющейся величины от положения равновесия в данный момент времени t. Постоянная φ представляет собой значение фазы в момент времени t = 0 и называется начальной фазой колебания. Значение начальной фазы определяется выбором начала отсчета. Величина x может принимать значения, лежащие в пределах от -A до +A.
- называется фазой колебаний. Фаза колебаний определяет смещение колеблющейся величины от положения равновесия в данный момент времени t. Постоянная φ представляет собой значение фазы в момент времени t = 0 и называется начальной фазой колебания. Значение начальной фазы определяется выбором начала отсчета. Величина x может принимать значения, лежащие в пределах от -A до +A.
Промежуток времени T, через который повторяются определенные состояния колебательной системы, называется периодом колебаний. Косинус - периодическая функция с периодом 2π, поэтому за промежуток времени T, через который фаза колебаний получит приращение равное 2π, состояние системы, совершающей гармонические колебания, будет повторяться. Этот промежуток времени T называется периодом гармонических колебаний.
Период гармонических колебаний равен: T = 2π/  .
.
Число колебаний в единицу времени называется частотой колебаний ν.
Частота гармонических колебаний равна: ν = 1/T. Единица измерения частоты герц (Гц) - одно колебание в секунду.
Круговая частота = 2π/T = 2πν дает число колебаний за 2π секунд.
33. Гармоническим осциллятором называется система, совершающая колебания, описываемые дифференциальным уравнением 
Физический маятник — это твердое тело, которое совершает колебания под действием силы тяжести вокруг неподвижной горизонтальной оси, которая проходит через точку О, не совпадающую с центром масс С тела. Если маятник из положения равновесия отклонили на некоторый угол α, то, используя уравнение динамики вращательного движения твердого тела, момент M возвращающей силы
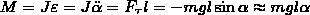

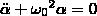

Из формулы вытекает, что при малых колебаниях физический маятник совершает гармонические колебания с циклической частотой ω0 и периодом

34. Гармоническим осциллятором называется система, совершающая колебания, описываемые дифференциальным уравнением 
Пружинный маятник — это груз массой m, который подвешен на абсолютно упругой пружине и совершает гармонические колебания под действием упругой силы F = –kx, где k — жесткость пружины. Уравнение движения маятника имеет вид
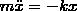
Из формулы  вытекает, что пружинный маятник совершает гармонические колебания по закону х = Асоs(ω0t+φ) с циклической частотой
вытекает, что пружинный маятник совершает гармонические колебания по закону х = Асоs(ω0t+φ) с циклической частотой
 и периодом
и периодом

Формула верна для упругих колебаний в границах, в которых выполняется закон Гука, т. е. если масса пружины мала по сравнению с массой тела. Потенциальная энергия пружинного маятника, используя (2) и формулу потенциальной энергии предыдущего раздела, равна 
35. Дифференциальное уравнение свободных затухающих колебание линейной системы имеет вид: d2x/dt2+2b×dx/dt+w02x=0. Здесь x- изменяющаяся при колебаниях физическая характеристика системы, b=const>0 – коэффициент затухания, а w0- циклическая частота свободных незатухающих колебаний той же системы, т.е. в отсутствие потерь энергии(при b=0). Решением этого уравнения затухающих колебаний имеет вид: x=A0e-bt×cos(wt+£). Здесь w=Öw02-b2), а постоянные величины А0 и £ зависят от начальных условий, т.е. от значений x и dx/dt в начальный момент времени (t=0).
Коэффициент затухания - количественная характеристика сопротивления колеблющейся системы колебательному движению.
Логарифмический декремент затухания - безразмерная характеристика затухающих колебаний, измеряемая натуральным логарифмом отношения двух последовательных максимальных отклонений колеблющейся величины в одну и ту же сторону.
ля характеристики интенсивности затухания вводят понятие логарифмического декремента затухания. Пусть Т - условный период затухающего колебания, Аn и An+1 - амплитудные значения функции x(t) для двух ее последовательных экстремумов (см. рис. 10.7). Величина d, равная:
d = ln(Аn /An+1) (10.12)
называется логарифмическим декрементом затухания. Выясним связь между d и d:
d = ln(Аn /An+1) = ln(A0·e - d·t/A0·e - d·(T + t)) = ln(e d·T) = d·T = d. (10.13)
Используя уравнение (10.13), можно преобразовать закон изменения амплитуды:
An = A0·e-d·t = A0·e-d·T·t/T = A0·e-d·n, (10.14)
где n = t/T - число колебаний за время t.
An = A0·e-d·n.
Если n = 1/d, то A0/An = e.
Величина 1/d равна числу колебаний, за которое их амплитуда уменьшается в е раз.
Если значение d невелико (d << 1), то можно показать, что
(An - An+1)/An = d. (10.15)
Логарифмический декремент связан с другой важной характеристикой колебаний - добротностью q следующим соотношением:
q = p/d.
36. Вынужденные колебания осциллятора под действием синусоидальной силы.; ma = F; m d2 x / dt (ст.2) = F; Fупр = - kx; Fтр = - b dx / dt; F = F0 sinΩt; (d2 x / dt (ст.2)) + (2 БЕТА dx / dt) + w 0 (ст.2) = (F0 / m) sin Ωt; Это дифференциальное уравнение описывает вынужденные колебания. В общем случае общее решение этого неоднородного дифференциального уравнения имеет вид: X(t) = X1(t) + X2(t); X1(t) является общим решением однородного диф. уравнения, описывающего свободный гармонический затухающий осциллятор. Видно, что после начала действия вынуждающей силы возникает сложный колебательный процесс, состоящий из суммы 2х колебаний – затухающего колебания X1(t) с частотой wt и незатухающего колебания с частотой Ωt. X1(t) за достаточно небольшой промежуток времени затухает и остается только одно колебание с частотой вынужденной силы Ω0. Это время, в течении которого X1(t) затухает, называется временем установки вынужденных колебаний.
37.
38.
39. Бегущая волна – это волна, которая переносит энергию.
Стоячая волна энергии не переносит. Стоячие волны образуюся в результате интерференции (наложения) 2х одинаковых, противоположных по направлению волн. Энергия, переносимая волной количественно характеризуется вектором плотности потока энергии, вектором Умова.
y = A sin (wt + φ0).
40. Фа́зовая ско́рость — скорость перемещения точки, обладающей постоянной фазой колебательного движения, в пространстве вдоль заданного направления. Обычно рассматривают направление, совпадающее с направлением волнового вектора, и фазовой скоростью называют фазовую скорость, измеренную именно в этом направлении, если противное не указано явно (то есть если явно не указано направление, отличное от направления волнового вектора).
X = 2ПИ / λ – ВОЛНОВОЕ ЧИСЛО (волновой вектор) – вектор, направление которого совпадает с направлением движения волны.
y (x, t)= Asin (wt – kx + φ0) – уравнение плоской синусоидальной бегущей волны, распространяющейся в положении направления оси X. Учитывая формулу Эйлера, эту плоскую волну можно записать в виде
y (x, t) = A e (ст. i (wt – kx + φ)); sinx(t) = A sin (wt – kx + φ0).
Фазовая скорость волны – это скорость распространения точки с постоянной фазой – Ф = const; v = dx / dt; Дифференцируем Ф и получаем:
dФ = d (wt – kx – φ0) = wdt – kdx à dx / dt = w/k – фазовая скорость волны!
41. Пpинцип супеpпозиции волн гласит, что волны от pазличных источников не взаимодействуют дpуг с дpугом и что сложное волновое поле от двух или большего числа источников находится путем геометpического сложения волн от отдельных источников, т.е. 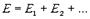
Это очень важный пpинцип. Он позволяет не только складывать волны, но и pаскладывать их, напpимеp, на независимые синусоидальные волны. Это означает, что любую волну, т.е. волну пpоизвольного пpофиля, всегда можно пpедставить как сумму синусоидальных волн с pазличными амплитудами, с pазличными фазовыми скоpостями, с pазличными частотами и с pазличными начальными фазами.
Групповая скорость – это скорость перемещения в пространстве этого волнового пакета.
S1 = Asin (wt - kx); S2 = Asin [(w + dw) t – (k + dk) x]; S = S1+S2;
S=2Asin (wt – kx) cos ((xdk – tdw) / 2); xdk – tdw = const; u = dx/dt;
d (xdk - tdw) = 0; dx dk – dt dw = 0 à dx / dt = dw / dk; u = dw / dk;
w = kv; dw = kdv + vdk; u = v + k (dv / dk); k = 2ПИ / λ;
dk = (2ПИ/ λ(ст.2)) dλ; u = v – λ (dv / dλ); Из этого выражения видно, что в зависимости от свойств среды групповая скорость может быть как больше, так и меньше фазовой скорости. Если среда не дисперсирующая, то dv / dλ = 0 и u = Ф. В теории относительности доказывается, что групповая скорость волны не может быть больше скорости света.
42. Эффект Доплера описывает сдвиг частоты сигнала в зависимости от относительного движения источника и приемника. Так волна, посланная источником, который удаляется от приемника, будет приниматься им на меньшей частоте по сравнению с волной от неподвижного источника или от источника, приближающегося к приемнику. Если же приемник приближается к неподвижному источнику, то частота принимаемой им волны будет больше по сравнению с неподвижным приемником или приемником, удаляющимся от источника. Это явление обнаружил Христиан Доплер в 1842 году.
Источник и приемник покоятся относительно среды, т.е.vист=vпр=0. Если v — скорость распространения звуковой волны в рассматриваемой среде, то длина волны l= vT=v/v 0. Распространяясь в среде, волна достигнет приемника и вызовет колебания его звукочувствительного элемента с частотой
n= v /l= v/(vT)=n 0
Следовательно, частота v звука, которую зарегистрирует приемник, равна частоте n0, с которой звуковая волна излучается источником.
43. Эффект Доплера описывает сдвиг частоты сигнала в зависимости от относительного движения источника и приемника. Так волна, посланная источником, который удаляется от приемника, будет приниматься им на меньшей частоте по сравнению с волной от неподвижного источника или от источника, приближающегося к приемнику. Если же приемник приближается к неподвижному источнику, то частота принимаемой им волны будет больше по сравнению с неподвижным приемником или приемником, удаляющимся от источника. Это явление обнаружил Христиан Доплер в 1842 году.
Источник приближается к приемнику, а приемник покоится, т.е. vист>0, vпр=0. Скорость распространения колебаний зависит лишь от свойств среды, поэтому за время, равное периоду колебаний источника, излученная им волна пройдет в направлении к приемнику расстояние vT (равное длине волны Я) независимо от того, движется ли источник или покоится. За это же время источник пройдет в направлении волны расстояние v ист T (рис.224), т.е. длина волны в направлении движения сократится и станет равной l'=l-vист Т=(v-v ист) Т, тогда
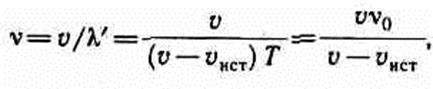
т. е. частота v колебаний, воспринимаемых приемником, увеличится в v/ (v-v ист)раз. В случаях 2 и 3, если vист<0 и v пр<0, знак будет обратным.
44. Эффект Доплера описывает сдвиг частоты сигнала в зависимости от относительного движения источника и приемника. Так волна, посланная источником, который удаляется от приемника, будет приниматься им на меньшей частоте по сравнению с волной от неподвижного источника или от источника, приближающегося к приемнику. Если же приемник приближается к неподвижному источнику, то частота принимаемой им волны будет больше по сравнению с неподвижным приемником или приемником, удаляющимся от источника. Это явление обнаружил Христиан Доплер в 1842 году.
Приемник приближается к источнику, а источник покоится, т.е. vпр>0, vист=0. В данном случае скорость распространения волны относительно приемника станет равной v+v пр. Так как длина волны при этом не меняется, то

т. е. частота колебании, воспринимаемых приемником, в (v+v пр )/v раз больше частоты колебаний источника.
45. Эффект Доплера описывает сдвиг частоты сигнала в зависимости от относительного движения источника и приемника. Так волна, посланная источником, который удаляется от приемника, будет приниматься им на меньшей частоте по сравнению с волной от неподвижного источника или от источника, приближающегося к приемнику. Если же приемник приближается к неподвижному источнику, то частота принимаемой им волны будет больше по сравнению с неподвижным приемником или приемником, удаляющимся от источника. Это явление обнаружил Христиан Доплер в 1842 году.
Источник и приемник движутся относительно друг друга. Используя результаты, полученные для случаев 2 и 3, можно записать выражение для частоты колебаний, воспринимаемых источником:
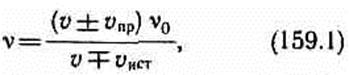
причем верхний знак берется, если при движении источника или приемника происходит их сближение, нижний знак — в случае их взаимного удаления. Из приведенных формул следует, что эффект Доплера различен в зависимости от того, движется ли источник или приемник. Если направления скоростей vпр и vист не совпадают с проходящей через источник и приемник прямой, то вместо этих скоростей в формуле (159.1) надо брать их проекции на направление этой прямой.
46. Макроскопические параметры – параметры значения которых можно определить с помощью приборов, ничего не зная об атомно-молекулярном строении вещества (давление, объем, температура). (Учащиеся записывают определение у себя в тетрадях).
Тепловое движение - беспорядочное движение молекул, атомов и ионов в газах, жидкостях и твердых телах.
Молекулы газов беспорядочно движутся с различными скоростями по всему объему газа.
Молекулы жидкости колеблются около равновесных положений и сравнительно редко перескакивают из одного равновесного положения в другое.
В твердых телах частицы колеблются около положения равновесия.
47. Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Изотермический процесс - посмотри в тетради.
48. Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Изобарный процесс - посмотри в тетради.
49. Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Изохорный процесс - посмотри в тетради.
50. Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
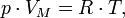 где
где
P — давление,
VM — молярный объём,
R — универсальная газовая постоянная
T — абсолютная температура,К
Так как 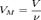 где
где  - количество вещества, а
- количество вещества, а  , где m- масса, M- молярная масса, уравнение состояния можно записать:
, где m- масса, M- молярная масса, уравнение состояния можно записать: 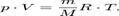 Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Изотермический процесс
51. Давление с точки зрения МКТ – это средний импульс, ежесекундно
передаваемый поверхности единичной площади в результате соударений с ней
молекул газа.
В результате можно получить основное уравнение молекулярно-
кинетической теории для давления газа: p = nkT
Здесь n =  – число молекул в единице объема, т.е. концентрация газа.
– число молекул в единице объема, т.е. концентрация газа.
52. Закон Максвелла описывается некоторой функцией f(ν), которая называется функцией распределения молекул по скоростям.
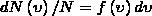
Применяя методы теории вероятностей, Максвелл получил функцию f(ν) — закон о распределеня молекул идеального газа по скоростям:

Из этой формулы видно, что конкретный вид функции зависит от вида газа (от массы молекулы) и от параметра состояния (от температуры Т).
График функции (1) приведен на рис. 1. Так как при возрастании ν множитель exp[–m0ν2/(2kT)] уменьшается быстрее, чем увеличивается множитель ν2, то функция f(ν), начинаясь от нуля, достигает максимума при νB, и затем асимптотически стремится к нулю. Кривая несимметрична относительно νB.

53.
54. БАРОМЕТРИЧЕСКАЯ ФОРМУЛА, определяет зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального газа, имеющего постоянную темп-ру Т и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения д одинаково), Б. ф. имеет след, вид: Р = Ро ехр [- g m (h-h 0)/RT], (I), где р - давление газа в слое, расположенном на высоте h, р 0 - давление на нулевом уровне (h = h 0), m - молекулярная масса газа, R - газовая постоянная, Т - абсолютная температура:
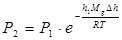
Распределение Больцмана — распределение частиц в потенциальном поле. Барометрическая формула является частным случаем распределения частиц в потенциальном поле. Преобразуем его используя уравнение Менделеева-Клапейрона в виде: p=nkT - распределение Больцмана.
55.
56. Переноса явления - кинетические процессы, Необратимые процессы, в результате которых в физической системе происходит пространственный перенос электрического заряда, массы, импульса, энергии, энтропии или какой-либо др. физической величины. П. я. описываются кинетическими уравнениями.
Теплопрово́дность — это перенос теплоты структурными частицами вещества (молекулами, атомами, электронами) в процессе их теплового движения. Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества. Явление теплопроводности заключается в том, что кинетическая энергия атомов и молекул, которая определяет температуру тела, передаётся другому телу при их взаимодействии или передаётся из более нагретых областей тела к менее нагретым областям. Иногда теплопроводностью называется также количественная оценка способности конкретного вещества проводить тепло. Подчиняется закону Фурье: 
57. Переноса явления -кинетические процессы, Необратимые процессы, в результате которых в физической системе происходит пространственный перенос электрического заряда, массы, импульса, энергии, энтропии или какой-либо др. физической величины. П. я. описываются кинетическими уравнениями.
Диффузия (от лат. diffusio — распространение, растекание), взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц вещества. Д. происходит в направлении падения концентрации вещества и ведёт к равномерному распределению вещества по всему занимаемому им объёму (к выравниванию химического потенциала вещества).
Д. имеет место в газах, жидкостях и твёрдых телах, причём диффундировать могут как находящиеся в них частицы посторонних веществ, так и собственные частицы (самодиффузия). Выполняется закон Фика: 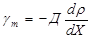
58. Переноса явления -кинетические процессы, Необратимые процессы, в результате которых в физической системе происходит пространственный перенос электрического заряда, массы, импульса, энергии, энтропии или какой-либо др. физической величины. П. я. описываются кинетическими уравнениями.
Вя́зкость (вну́треннее тре́ние) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно.
Различают динамическую вязкость и кинематическую вязкость.  .
.
59. Работа газа при изменении его объема.
Работа совершается только тогда, когда изменяется объем.
Найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде. Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу dA=Fdl=pSdl=pdV, где S-площадь поршня, Sdl=dV-изменение объема системы. Таким образом, dA= pdV.(1)
Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы (1): A= òpdV(от V1 до V2).(2)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
60. Первое начало термодинамики представляет собой обобщение опытных фактов и является по сути дела законом сохранения энергии, примененным к тепловым явлениям. Первое начало термодинамики имеет несколько формулировок. Одна из формулировок гласит: количество теплоты, переданное системе, идет на изменение внутренней энергии и на совершение системой работы над внешними телами, т. е. Q=∆U+A В этом уравнении изменение внутренней энергии, Количество теплоты может быть положительным (Q>0), если тело получает теплоту, и отрицательным (Q>0), если тело отдает теплоту.
В дифференциальной форме это запишется следующим образом δQ=dU+δA
где dU и δA Первое начало термодинамики показывает, что теплоту можно преобразовывать в работу, т. е. выделять из неупорядоченного движения упорядоченное. Устройство, в котором теплота превращается в работу, называется тепловой машиной.
61. Применение первого начала термодинамики к изотермическому процессу:
Поскольку T = const, изменение температуры dT = 0. Следовательно не изменяется и внутренняя энергия, то есть

Тогда получаем, что
В изотермическом процессе всё полученное газом количество теплоты идёт на совершение газом работы против внешних сил: бQT = бA
62. Применение первого начала термодинамики к изобарному процессу:
При p = const и температура и объём газа изменяться могут. Следовательно и внутренняя энергия изменяется и совершается работа. Поэтому вид первого начала ТД для изобарного процесса ничем не отличается от общей формы его записи, то есть В изобарном процессе полученное газом количество теплоты идёт на увеличение его внутренней энергии (нагревание) газа и совершение газом работы против
внешних сил: бQp = бU + pdV
Работа зависит от пути перехода 1→ 2, поэтому 1ое начало термодинамики можно переписать в виде
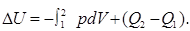 где
где  U = U2 − U1 — изменение внутренней энергии системы.
U = U2 − U1 — изменение внутренней энергии системы.
63. Применение первого начала термодинамики к изохорному и адиабатному процессам.
Изохорный процесс (V = const)
Поскольку V = const, изменение объёма dV = 0. Это означает, что работа не совершается: dA = pdV = 0.
Следовательно: В изохорном процессе всё полученное газом количество теплоты идёт на увеличение внутренней энергии (нагревание) газа: бQV = бU.
Адиабатный процесс (Q = const)
Этот вид изопроцессов мы ещё не рассматривали. Поэтому, прежде чем перейти к происходящим в нём превращениям энергии, определимся с самим процессом. Итак, Адиабатным называется процесс, происходящий без теплообмена с окружающей средой.
Поскольку (по определению) Q = const, то dQ = 0 и 1ое начало термодинамики для адиабатного процесса принимает вид: dA = бU.
Адиабатный процесс описывается уравнением Пуассона (с выводом этого уравнения можно познакомиться здесь):
 или
или 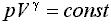
Здесь  — показатель адиабаты, i — число степеней свободы.
— показатель адиабаты, i — число степеней свободы.
64. Энтропия — мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Энтропия впервые введена Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
 где dS - приращение энтропии; δQ - минимальная теплота подведенная к системе; T - абсолютная температура процесса.
где dS - приращение энтропии; δQ - минимальная теплота подведенная к системе; T - абсолютная температура процесса.
Энтропия термодинамического состояния системы определяется через термодинамическую вероятность как: S = k·lnW, где k – постоянная Больцмана. Это выражение энтропии через термодинамическую вероятность получило название "принцип Больцмана".
65. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая невозможность перехода всей внутренней энергии системы в полезную работу.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
66. Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов.
Цикл Карно назван в честь французского военного инженера Сади Карно, который впервые его исследовал в 1824 году.
Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении, при этом энтропия адиабатически изолированной (без теплообмена с окружающей средой) системы не меняется.
Цикл Карно и максимальный КПД тепловой машины.
Представим себе следующий цикл:
Фаза А→Б. Рабочее тело с температурой, равной температуре нагревателя, приводится в контакт с нагревателем. Нагреватель сообщает рабочему телу  тепла в изотермическом процессе (при постоянной температуре), при этом объём рабочего тела увеличивается.
тепла в изотермическом процессе (при постоянной температуре), при этом объём рабочего тела увеличивается.
Фаза Б→В. Рабочее тело отсоединяется от нагревателя и продолжает расширяться адиабатически (без теплообмена с окружающей средой). При этом его температура уменьшается до температуры холодильника.
Фаза В→Г. Рабочее тело приводится в контакт с холодильником и передает ему  тепла в изотермическом процессе. При этом объём рабочего тела уменьшается.
тепла в изотермическом процессе. При этом объём рабочего тела уменьшается.
Фаза Г→А. Рабочее тело адиабатически сжимается до исходного размера, и его температура увеличивается до температуры нагревателя.
Его КПД равен, таким образом,
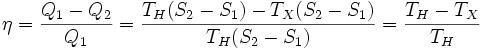
то есть, зависит только от температур холодильника и нагревателя. Видно, что 100%-ный КПД можно получить только в том случае, если температура холодильника есть абсолютный нуль, что недостижимо.
Можно показать, что КПД тепловой машины Карно максимален в том смысле, что никакая тепловая машина с теми же температурами нагревателя и холодильника не может обладать бо́льшим КПД.
Заметим, что мощность тепловой машины Карно равна нулю, так как передача тепла в отсутствие разности температур идёт бесконечно медленно.
67. Фазы и фазовые превращения. Фазовые диаграммы.
фаза — термодинамически равновесное состояние вещества, качественно отличающееся по своим физическим свойствам от других равновесных состояний того же вещества.
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.
Фа́зовая диагра́мма (диаграмма состоя́ния) — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме (носит название фигуративной точки).
68. pVM= RT - уравнениеКлапейрона—Менделеева
P = n0 k T – другая форма записи этого уравнения
Критическая точка — сочетание значений температуры  и давления
и давления  (или, что эквивалентно, молярного объёма
(или, что эквивалентно, молярного объёма 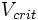 ), при которых исчезает различие в свойствах жидкой и газообразной фаз вещества.
), при которых исчезает различие в свойствах жидкой и газообразной фаз вещества.
Критическая температура фазового перехода — значение температуры в критической точке. При температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
69. Реальные газы. Уравнение Ван-дер-Ваальса.
Реальные газы. При движении молекулы вдали от стенок сосуда, в котором заключен газ, на нее действуют силы притяжения соседних молекул, но равнодействующая всех этих сил в среднем равна нулю, т.к. молекулу со всех сторон окружает в среднем одинаковое число соседей. При приближении некоторой молекулы к стенке сосуда все остальные молекулы газа оказываются по одну сторону от нее и равнодействующая всех сил притяжения оказывается направленной от стенки сосуда внутрь газа. Это приводит к тому, что уменьшается импульс, передаваемый молекулой стенке сосуда. В результате давление газа на стенки сосуда уменьшается по сравнению с тем, каким оно было бы в отсутствие сил притяжения между молекулами: p = p идеального+ Δ p. Вместо уравнения идеального газа получаем
p + Δ p = nkT; Δ p = a/V(ст.2);
Где a – постоянная, зависящая от вида газа. Для одного моля газа получаем p+a/V(ст.2) = R T / V; Поправка: при любых давлениях, объем газа не может стать равным нулю. Уравнение Ван-дер-Ваальса:
(p + a / V (ст.2)) (V - b) = RT, где b – так называемый “запрещенный объем”.
уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
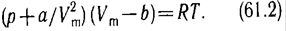
Для произвольного количества вещества ν газа (ν = m/M) с учетом того, что V = ν Vm, уравнение Ван-дер-Ваальса примет вид
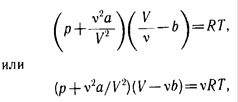
где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта
состояний газа и решаются относительно а и b).
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также весьма приближенное, хотя и лучше (особенно для несильно сжатых
газов) согласуется с опытом, чем уравнение состояния идеального газа.
70. Средняя кинетическая энергия частиц. df (v) / N = f (v) dv; Кинетическая энергия одной частицы: E = m0 v (ст.2) / 2; v = (корень) 2E / m0;
Формула распределения частиц по энергии: f (E)= (-2 / [корень] ПИ) (k T (ст. – 3 /2) [корень E] e (ст. – E / fT)); С помощью этой формулы можно расчитать кинетическую энергию частиц: <E> = (интеграл 0 - беск) 2 f (E) dE = (3/2) kT.
71. Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса (61.2) для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют довольно своеобразный характер. При высоких температурах (T>Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой. Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк и давление рк называются также критическими. Состояние с критическими параметрами (рк, Vк, Тк) называется критическим состоянием. При низких температурах (Т<Тк) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
72. Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса (61.2) для моля газа. Эти кривые имеют довольно своеобразный характер. При высоких температурах (T>Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой. Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк и давление рк называются также критическими. Состояние с критическими параметрами (рк, Vк, Тк) называется критическим состоянием. При низких температурах (Т<Тк) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса (61.2) к виду: pV3m-(RT+pb) V2m+aVm-ab=0.(62.1)
Уравнение (62.1) при заданных р и Т является уравнением третьей степени относительно Vm;
Рассматривая различные участки изотермы при Т<Тк (рис.90), видим, что на участках 1—3 и 5—7 при уменьшении объема Vm давление р возрастает, что естественно. На участке 3—5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7—6—2—1. Часть 7—6 отвечает газообразному состоянию, а часть 2—1 — жидкому. В состояниях, соответствующих горизонталь-ному участку изотермы 6—2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 468; Нарушение авторских прав?; Мы поможем в написании вашей работы!