
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обосновать ответ. Процесс протекает с уменьшением числа молей в системе
|
|
|
|
Процесс протекает с уменьшением числа молей в системе
2) процесс протекает с увеличением числа молей в системе?
Ответ: Если процесс идет с уменьшением числа молей, то разбавление инертным компонентом смещает равновесие в сторону реагентов.
1) Если процесс идет с увеличением числа молей, то разбавление инертным компонентом смещает равновесие в сторону продуктов.
Применяется ↓ Р в системе (парциальное давление в компонентов смеси) (по принципу Ле-Шателье) для смещения равновесия вправо, при ↓ Р уменьшается скорость химической реакции(по стехиометрии) r ~ P n-1
Чем больше степень изменения количества молей, тем в большей степени система реагирует на изменение давления.
Р эффективное = Р общее(1- Сi)2
Рi = Nj P – закон Дальтона. Эффект разбавления (Nj ↓) подобен снижению давления в системе. Инертный компонент: дешевый, легко отделяется, подавляет побочные реакции, препятствует отложению углерода в органических системах. Для экзотермической реакции является теплоносителем для поддержания температуры.
Наиболее часто применяемый инертный агент – вод. пар.
14. С чем связаны ограничения в выборе объёмной скорости в производстве этанола методом прямой гидратации? Обосновать ответ. Какими соображениями определяется выбор объёмной скорости в циркуляционных процессах. С2 Н4 + Н2О ↔С2Н5ОН, ∆Н<0
Ответ: Процесс сложный, обратимый, экзотермический. При температуре максимальной активности катализатора выход составляет  ≈10%, что обуславливает большой размер рецикла. В случаях, когда размер рецикла велик, процесс целесообразно проводить с большими объемными скоростями (дабы уменьшить размеры аппаратуры). Однако в случае гидратации этилена объемная скорость газообразных веществ относительно невелика (порядка 1500 м3/ч). это обусловлено тем, что при больших скоростях велик унос фосфорной кислоты (которая является катализатором), что вызывает коррозию и понижает срок службы оборудования. Кроме того, при высоких объемных скоростях сложно организовать автотермический процесс.
≈10%, что обуславливает большой размер рецикла. В случаях, когда размер рецикла велик, процесс целесообразно проводить с большими объемными скоростями (дабы уменьшить размеры аппаратуры). Однако в случае гидратации этилена объемная скорость газообразных веществ относительно невелика (порядка 1500 м3/ч). это обусловлено тем, что при больших скоростях велик унос фосфорной кислоты (которая является катализатором), что вызывает коррозию и понижает срок службы оборудования. Кроме того, при высоких объемных скоростях сложно организовать автотермический процесс.
Объёмную скорость процесса выбирают так, чтобы обеспечить высокую интенсивность и производительность процесса. В то же время не следует выбирать слишком большие скорости, т. к. в этом случае возможен «проскок» реагента
15. С чем связана необходимость рециркуляции продуктов реакции в ХТС?
Какие потоки ещё циркулируют в ХТС и для каких целей?
Ответ: В ХТС могут рециркулировать исходные, промежуточные и продукты.
1) рецикл исходных веществ связан с неполнотой их превращения. Причинами могут быть:
· Термодинамические ограничения
· Малая скорость процесса
· Ограниченное время контактирования
· Избыток одного из реагентов
2) рецикл продуктов нужен для
· снижения интенсивности процесса
· увеличения скорости автокаталитических процессов
· для регенирирования физ. Св-в (напр., температуры)
3) рецикл промеж. В-в
· катализатор
· растворители
· водооборот
16. Зачем нужен избыток кислорода в процессе обжига колчедана? Обосновать способы интенсификации гетерогенных процессов в системах газ твердое в зависимости от природы лимитирующей стадии.
Ответ: Избыток кислорода нужен для интенсификации процесса, он протекает в диффузионной области, лимитирующей стадией является диффузия кислорода из объема потока к поверхности твердой частицы FeS2 через слой образовавшегося оксида. Избыток кислорода увеличивает движущую силу процесса (равновесие смещается вправо).
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
1) лимитирующая стадия внешняя диффузия (из объема к поверхности частицы)
r = β (cv cf), Сv концентрация реагента в потоке
для интенсификации процесса:
- повышать Cv
- увеличить коэффициент массоотдачи β
β = D/δ, δ толщина газовой пленки, D коэффициент молекулярной диффузии. D - зависит от вещества, мало зависит от T и P. Легче уменьшить δ:
- увеличить линейную скорость потока, обтекающего твердую частицу (пленку срывает)
- турбулизация потока (аппараты с кипящим слоем ТМ)
- увеличить поверхность контакта
2) процесс лимитирует внутренняя диффузия (через слой золы к поверхности ядра)
r = β΄ (CF CS), СF концентрация реагента на поверхности частицы
- Увеличить CF
- β΄
β΄ = D эфф. / (R r), R радиус частицы, r радиус ядра
Dэфф. повысить сложно (зависит от прористости и коэффициента извилистости пор), нужно уменьшить толщину слоя твердых продуктов реакции (R r) измельчить частицы
2) процесс лимитируется химической реакцией.
r = k · Cs, k константа скорости реакции, Сs концентрация газообразного реагента на поверхности ядра
Cs = Cv = Cf
Для интенсификации следует:
- повысить концентрацию газообразного реагента Сs
- увеличить константу скорости k. Она зависит от температуры, в соответствии с уравнением Аррениуса с ростом температуры увеличивается по экспоненте.
17. Как повлияет повышение температуры процесса на равновесный выход продуктов реакции Rи S при условиях 1) и 2)?
aA + bB =; rR + sS
1) ΔH < 0, ΔS > 0
2) ΔH > 0, ΔS > 0
Обосновать ответ. Какова связь между изменением стандартного изобрано-изотермического потенциала (свободной энергии Гиббса) и констнантой равновесия?
Ответ: ΔG = Δ;H TΔ;S
ΔG = - RTlnKp - связь свободной энергии Гиббса и константы равновесия. Порядок и знак величины Δ;G позволяют качественно предвидеть положение равновесия реакции. Если Δ;G << 0, равновесие сдвинуто вправо, выход продукта велик, Кр имеет большое числовое значение. Если Δ;G>> 0, то равновесие сдвинуто влево, выход продукта мал, Кр <<1.
- RTlnKp = Δ;H TΔ;S
lnKp = ΔS/R ΔH/RT
продифференцируем уравнение, получим уравнение изобары Вант-Гоффа:
dlnKp/dT = ΔH/T2
1) экзотермическая реакция, Кр большая положительная величина, реакция термодинамически разрешена при любых температурах. Так как Δ;H < 0, то dlnKp/dT < 0 и константа равновесия уменьшается с увеличением температуры:
X* - равновесный выход продуктов реакции
То же самое согласно принципу Ле Шателье повышение температуры смещает равновесие в сторону уменьшения воздействия, то есть в сторону обратной эндотермической реакции, константа уменьшается, выход тоже.
2) эндотермическая реакция, протекает с увеличением энтропии, термодинамически разрешена только в области высоких температур. ΔH > 0, dlnKp/dT > 0, с повышением температуры константа равновесия увеличивается, равновесие смещается в сторону прямой реакции, выход продуктов увеличивается.
Влияние энтропийного фактора: при изменении температуры процесса равновесие смещается в направлении, для которого изменение энтропии имеет тот же знак, что и изменение температуры.
в обоих случаях ΔS > 0, с повышением температуры энтропийный фактор смещает равновесие вправо, увеличивая выход продуктов.
18. Энергия активации реакции окисления 2 NO + O2 ↔ 2NO2 (∆H <O) cоставляет -7,5 кДж/моль. Как изменится скорость реакции с увеличением температуры? Какие еще параметры влияют на скорость гомогенной реакции?
Ответ: Скорость гомогенной реакции – изменение числа молей в единицу времени в единице реакционного объема.
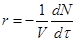 . Скорость данной реакции описывается выражением
. Скорость данной реакции описывается выражением  .
.
С термодинамической точки зрения в случае обратимой экзотермической реакции повышение температуры будет смещать равновесие в сторону исходных веществ. С увеличением температуры скорость прямой реакции будет уменьшаться.
Зависимость константы скорости k от температуры описывается уравнением Аррениуса.  . Величина энергии активации показывает степень влияния температуры на скорость химической реакции. Чем больше величина энергии активации Еа, тем большее влияние на скорость оказывает температура. Для большинства реакций энергия активации положительна и константы скорости таких реакций возрастают по экспоненте с увеличением температуры. Данная реакция относится к числу немногих реакций с отрицательной Еа. Это связано с механизмом процесса. Реакция протекает через образование димера.
. Величина энергии активации показывает степень влияния температуры на скорость химической реакции. Чем больше величина энергии активации Еа, тем большее влияние на скорость оказывает температура. Для большинства реакций энергия активации положительна и константы скорости таких реакций возрастают по экспоненте с увеличением температуры. Данная реакция относится к числу немногих реакций с отрицательной Еа. Это связано с механизмом процесса. Реакция протекает через образование димера.
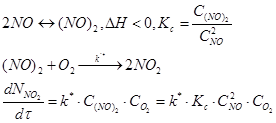
Суммарная скорость реакции определяется соотношением k* и Кс. С увеличением температуры k* растет медленнее, чем уменьшается Кс. Т.о. с кинетической точки зрения скорость реакции уменьшается с увеличением температуры. Влияние температуры с кинетической и термодинамической точек зрения одинаково. Требуется невысокая температура. Данная реакция является самой медленной стадией в производстве азотной кислоты и проводится при t=10 – 50 ºC.
Параметры, влияющие на скорость гомогенной реакции.
Скорость зависит от константы скорости (изменяется при изменении температуры в соответствии с уравнением Аррениуса) и от движущей силы процесса (степенью удаленности от состояния равновесия). В случае необратимых реакций движущая сила определяется только степенью превращения, т.е. концентрацией реагирующих веществ. В случае обратимых реакций движущая сила реакции может меняться при изменении состояния равновесия. Помимо кинетического фактора в этом случае на скорость реакции влияют факторы, смещающие равновесие.
1.Для обратимых реакций увеличение концентрации реагентов или уменьшение концентрации продуктов вызывают смешение равновесия в сторону продуктов и увеличение скорости прямой реакции. Для обратимых реакций, протекающих в газовой фазе, идущих с уменьшением числа газообразных мол-л увеличение давления способствует протеканию прямой реакции. (с увеличением – наоборот).
2.Для обратимых эндотермических реакций увеличение температуры вызывает увеличение скорости прямой реакц. Для обр. экзотрермич. р-ций зависимость скорости от температуры описывается кривой с максимумом. Вначале увеличение скор. обусловлено ростом константы скорости. Уменьшение скор. при дальнейшем росте температуры происходит из-за уменьшения движущей силы проц.
3. Скорость необр. р-ций растет с ростом температуры за счет роста конст. скор.
19. Какой зависимостью описывается изменение скорости процесса с ростом температуры для обратимой экзотермической реакции: А↔В (∆Н<0)? Каким способом реализуют в промышленности подобного типа процессы?
Ответ: Для данной реакции влияние температуры с т. зр. кинетики и термодинамики различно.
1. Кинетика. В соотв. с ур. Аррениуса с↑ Т ↑ r. 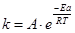
2. Термодинамика. Т.к. реакция – экзотермическая, ↑ Т приводит к смещению равновесия в сторону исходных в-в.
 -степень превращ. комп. А,
-степень превращ. комп. А,  -равновесная степень превр.,
-равновесная степень превр.,
0<  <1,
<1, 

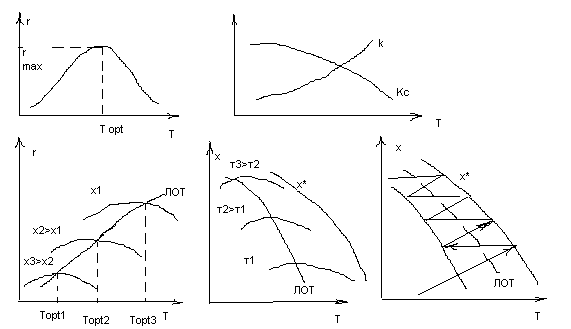
С ↑ Т ↑ k, но равновесие смещается в сторону исх. в-в., т.е. ↓  *. При невысоких температурах рост температуры значительно влияет на константу скорости и ↑ k сказывается сильнее, чем уменьшение движущей силы, с ↑ Т r↑. При достаточно высоких темп. – наоборот. Очевидно, что зависимость скорости реакции от темп. описывается кривой с максимумом и существует оптимальная температура, при которой скор. процесса максимальна при определенной степени превращения
*. При невысоких температурах рост температуры значительно влияет на константу скорости и ↑ k сказывается сильнее, чем уменьшение движущей силы, с ↑ Т r↑. При достаточно высоких темп. – наоборот. Очевидно, что зависимость скорости реакции от темп. описывается кривой с максимумом и существует оптимальная температура, при которой скор. процесса максимальна при определенной степени превращения  . При этом увеличение степени превр. приводит к уменьшению максимальной скорости (т. к. уменьшается макс. движущая сила) и кривая зависимости r от Т смещается в сторону более низких температур. Линия, соединяющая максимумы на кривых зависимости r от Т при различных степенях превращения – линия оптимальных температур (ЛОТ). В промышленности обратимые экзотермические процессы ведутся по ЛОТ, что позволяет добиться максимальной скорости процесса в каждый момент времени. Для этого процесс ведут с уменьшением температуры при увеличении времени контактирования. В действительности вести процесс точно по ЛОТ невозможно. Процесс ведут по кривой, максимально приближенной к ЛОТ, поочередно пропуская реакционную смесь через зоны реакционного объема, где происходит некоторый саморазогрев смеси и увеличение конверсии, и охлаждая реакционную смесь (конверсия при этом не меняется), например, путем ввода реагентов с байпасной линии. Примеры обратимых экзотермических процессов в промышленности, проводимых по ЛОТ – синтез аммиака из азота и водорода, окисление диоксида серы до триоксида серы при получении серной кислоты.
. При этом увеличение степени превр. приводит к уменьшению максимальной скорости (т. к. уменьшается макс. движущая сила) и кривая зависимости r от Т смещается в сторону более низких температур. Линия, соединяющая максимумы на кривых зависимости r от Т при различных степенях превращения – линия оптимальных температур (ЛОТ). В промышленности обратимые экзотермические процессы ведутся по ЛОТ, что позволяет добиться максимальной скорости процесса в каждый момент времени. Для этого процесс ведут с уменьшением температуры при увеличении времени контактирования. В действительности вести процесс точно по ЛОТ невозможно. Процесс ведут по кривой, максимально приближенной к ЛОТ, поочередно пропуская реакционную смесь через зоны реакционного объема, где происходит некоторый саморазогрев смеси и увеличение конверсии, и охлаждая реакционную смесь (конверсия при этом не меняется), например, путем ввода реагентов с байпасной линии. Примеры обратимых экзотермических процессов в промышленности, проводимых по ЛОТ – синтез аммиака из азота и водорода, окисление диоксида серы до триоксида серы при получении серной кислоты.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1512; Нарушение авторских прав?; Мы поможем в написании вашей работы!