
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Производство стирола дегидрированием этилбензола по реакции
Ответ.
Ответ.
Понижение давления реализуется введением в реакционную смесь инертного компонента, в нашем случае - водяного пара.
Pэф. = Pобщ.(1-Ci), где Ci – содержание инерта.
Это технологическое решение имеет несколько преимуществ:
* Водяной пар дешев.
* Водяной пар легко отделяется на завершающих стадиях технологической цепочки.
* Водяной пар препятствует коксообразованию, а именно газифицирует образующийся на стенках труб кокс.
34. Процесс экзотермичен. Реагенты и продукты находятся в газовой фазе. Число молей продуктов больше, чем число молей реагентов. Процесс протекает с возрастанием энтропии. Как сместить равновесие реакции в сторону образования продуктов?
1) Оценка влияния на равновесие температуры.
Процесс экзотермичен => ∆H < 0.
Процесс протекает с возрастанием энтропии => ∆S > 0.
Исходя из ∆G = ∆H - T∆S,
∆G = - RTLn(Кр);
получим Ln(Кр) = ∆S/R - ∆H/RT. Окончательно, с учетом знаков:
Ln(Кр) = ∆S/R + │∆H│/RT, откуда очевидно что с ростом температуры константа скорости прямой реакции уменьшается. Т.е. для смещения равновесия в сторону образования продуктов необходимо понижать температуру.
2) Оценка влияния на равновесие давления.
Т. к. число молей продуктов больше, чем число молей реагентов, то понижение давления, в соответствии с принципом Ле Шатерье, сместит равновесия в сторону образования продуктов.
35. Окисление SO2 в SO3: SO2 + 0,5О2 ↔SO3 (∆ H < 0) – обратимая экзотермическая реакция, которая проводится на ванадиевом катализаторе в интервале температур 400-6000 С. Какой приём применяют для получения большого выхода продукта? Объяснить суть приёма.
Ответ:
 У данной реакции большая величина энергии активации (
У данной реакции большая величина энергии активации (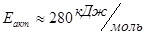 ), поэтому применяют катализаторы. Чаще всего ванадиевые. У применяемых катализаторов рабочая температура 400-600 0С.
), поэтому применяют катализаторы. Чаще всего ванадиевые. У применяемых катализаторов рабочая температура 400-600 0С.
Так как реакция экзотермическая, то для смещения равновесия вправо следует понижать температуру. Нижний предел ограничен температурой зажигания катализатора: 400 0С. Но при такой температуре очень мала скорость процесса и при промышленных объемных скоростях не достигается требуемой степени превращения. При повышении температуры возрастает скорость реакции, но равновесие смещается влево, т.е. равновесная концентрация продукта (SO3) уменьшается (см. линию равновесия). Верхний предел ограничен 600 0С, т.к. при более высоких температурах катализатор теряет активность. Для получения высокой конверсии с требуемой скоростью процесс ведут по линии оптимальных температур (ЛОТ). Суть приёма состоит в следующем. Процесс ведут с уменьшением температуры в секционированном контактном аппарате: сначала реакционная смесь нагревается до температуры зажигания катализатора 400 0С и поступает в первый слой контактного аппарата. В этих условиях велика скорость процесса и быстро достигается конверсия, близкая к равновесной. При этом реакционная смесь разогревается приблизительно до 600 0С. После разогрева до этой температуры реакционная смесь охлаждается. Чаще всего выносными теплообменниками, реже – байпасным введением холодного воздуха. Последнее кстати дополнительно смещает равновесие в сторону продукта (повышение концентрации реагента). Затем охлаждённая смесь снова поступает уже во второй слой контактного аппарата. После разогрева реакционной смеси до определённой температуры (уже < 600 0С), она поступает в следующий теплообменник. И так далее. В каждом последующем слое контактного аппарата температура понижается по сравнению с предыдущей, при этом уменьшается скорость процесса и увеличивается степень превращения. Количество слоёв определяется из экономических соображений. Таким образом, благодаря высокой температуре вначале процесса мы получаем большую скорость реакции. А постепенно охлаждая реакционную смесь в каждом слое повышаем выход продукта. (в данном случае все слова «конверсия» и «степень превращения» можно заменить на «выход», т.к. процесс простой и селективность = 1).
36. В эндотермическом газофазном процессе число молей продуктов меньше, чем число молей реагентов. Реакция характеризуется убылью энтропии. Как сместить равновесие реакции в сторону образования продуктов?
Ответ: Энергия Гиббса равна  . Из условий задачи получаем:
. Из условий задачи получаем:  (эндотермический процесс),
(эндотермический процесс), 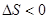 (энтропия уменьшается). Получаем, что
(энтропия уменьшается). Получаем, что 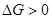 . При
. При 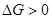 равновесие реакции сдвинуто влево, выход продукта мал. (это почти не реализуемые процессы).
равновесие реакции сдвинуто влево, выход продукта мал. (это почти не реализуемые процессы).
В соответствии с принципом Ле Шателье («Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведённого воздействия, и положение равновесия сместится в том же направлении». Т.е. равновесие смещается в сторону тех условий, которые ослабляют внешнее воздействие.) сместить равновесие в сторону образования продуктов можно следующим образом:
- повысить давление, т.к. число молей продуктов меньше, чем число молей реагентов.
- если есть инертные примеси, понизить их содержание (равносильно повышению давления).
- несмотря на то, что реакция эндотермическая, повышением температуры мы не сместим равновесие в сторону продуктов, т.к. энтропия уменьшается, и повышая температуру, мы лишь увеличим положительное значение энергии Гиббса.
37. Какие приемы используют для сокращения потерь энергии в химико-технологических системах?
Какие приёмы используются для реализации принципа наилучшего использования энергии при проведении процессов при высоких температурах?
Ответ: Высокотемпературные процессы (при t>273К) используют главным образом для изменения физико-хим свойств сырья, а также для интенсификации хим реакций. Эту энергию получают при сжигании различных видов топлива (угля и продуктов его переработки: кокса, доменного и коксового газа, жидкого топлива), непосредственно в технологических устройствах. Необходимо создать: безотходное производство, технологическое комбинирование, комплексное использование сырья, разработка энергосберегающих технологий- агрегатов большой единичной мощности-сконцентрировать энергию, организовать химико-энергетические системы, в которых наряду с продуктом образуется энергия-продукт.Это уменьшит капиталовложения, материалоемкость, увеличит производительность труда, сократится производственная площадь.
В структуре себестоимости стоимость энергии достигает 60%, а степень использования энергии в ХТС не превышает 30%. Следовательно есть тепловые выбросы.Задача: надо уменьшить расход энергии на единицу выпускаемой продукции и сократить потери в окружающую среду.Для этой цели используются следующие приемы:
1. регенерация теплоты, т.е. подогрев входящих потоков нагретыми продуктами реакции.
Это осуществляется:
1) непосредственный теплообмен,
2) через теплообменную поверхность.Но: бывают очень высокие температуры и требуется большая поверхность дорогостоящих материалов, химически-агрессивные среды.
3) При помощи тепловых агентов
2. сокращение тепловых потерь
1) изоляция аппаратов
2) подача исходных реагентов в пространство между катализаторной коробкой и стенкой аппарата
3.принцип противотока
4. организация автотермических процессов, когда количество теплоты, необходимое для нагрева газа до заданной температуры перед входом в реактор, поставляется газом покидающим реакционное пространство
1) регулирование нагрузки на реактор
2) совмещение реакций с разными тепловыми эффектами(получение формальдегида окислительным дегидрированием метанола)
5. энерготехнологические системы: наряду с химическим продуктом производится
энергия.
38. В исследуемой системе реакция аА + вВ ↔ сС (∆Н > 0) идёт в газовой фазе. ∆G0298 = 60 кДж/моль. Что нужно сделать, чтобы сместить равновесие в сторону продукта реакции?
Ответ: Ле-Шателье: если на систему, находящуюся в состоянии равновесия, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса,течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении. -Q, Н>0 увеличиваем температуру, самопроизвольное протекание процесса невозможно, Кр< 1, вводим реагент в избытке
.
39. Какие приемы применяют для реализации принципа экологической безопасности при производстве азотной кислоты? Какие требования предъявляются к отходам, образующимся в химико-технологических системах?
Ответ: Неуклонный рост производства азотной кислоты тесно связан с увеличением объема отходящих газов, а следовательно, с ростом количества выбрасываемых в атмосферу оксидов азота. Оксиды азота очень опасны для любых живых организмов. Некоторые растения повреждаются уже через 1 ч пребывания в атмосфере, содержащей 1 мг оксидов в 1 м воз духа. Оксиды азота вызывают раздражение слизистой оболочки дыхательных путей, ухудшение снабжения тканей кислородом и другие нежелательные последствия.
Хвостовые газы производства азотной кислоты содержат после абсорбционных колонн от 0,05 до 0,2% оксидов азота, которые по санитарным требованиям без дополнительной очистки запрещено выбрасывать в атмосферу.
Радикальное решение проблем очистки хвостовых газов — каталитическое восстановление оксидов азота горючими газами — водородом, природным газом, оксидом углерода, аммиаком. Условия проведения процесса и тип используемого катализатора определяются видом применяемого газа. Восстановление оксидов азота снижает их содержание в очищенном газе до 0,001—0,005%, что обеспечивает санитарные нормы по содержанию оксидов азота в приземном слое воздуха при мощностях производства кисло ты до 1 млн т/год, сосредоточенных в одной точке и при высоте выброса 100—150 м.
На ряде существующих предприятий по производству азотной кислоты под давлением применен метод очистки, в котором восстановителем является природный газ, а в качестве катализатора используется палладий на носителе, в качестве второго слоя катализатора — носитель (оксид алюминия).
На катализаторе протекают следующие реакции:
СН4 + 202→СО + 2Н
СН4 + 2N02→ N2 + СО2+H2O
СН4 + 4N0 → 2N2 + Н2O + СО2
Метод обеспечивает снижение содержания оксидов азота в выхлопных газах до 0,005%. Теплота реакции используется для получения пара. данный метод очистки органически связан с технологией производства азотной кислоты. Он нашел применение в агрегате, работающем под давлением 0,716 МПа, и в агрегате АК-72.
В качестве восстановителя вместо природного газа применяют также аммиак. Этот метод характеризуется тем, что на алюмованадиевом катализаторе аммиак реагирует только с оксидами азота, т. е. обеспечивает селективное восстановление:
NН3 + бN0 – 5N2 + 6Н2O
Одним из наиболее реальных способов утилизации оксидов азота, обеспечивающих санитарные нормы содержания оксидов азота в приземном слое атмосферы после рассеивания их из выхлопной трубы, является адсорбционно-десорбционный метод, в котором используется непрерывно циркулирую сорбент (силикагель). Разработаны способы адсорбции на молекулярных ситах, промывки кислым раствором мочевины и другими промывными жидкостями.
На современных установках получения азотной кислоты нет постоянных источников сточных вод. Эти установки потребляют большое количество оборотной охлаждающей воды. Растворы, периодически сливаемые из насосов и другого оборудования, например при проведении ремонта, собирают в приямок и нейтрализуют.
Основные требования, применяемые к отходам: 1) должны легко утилизироваться или регенерироваться, 2) должны легко аккумулироваться природными системами.
40. В исследуемой системе основная (1) и побочная (2) реакции протекают в газовой фазе и обратимы в широком диапазоне температур:
А + В ↔ С + D (∆ Н < 0) (1)
B ↔ R + S (∆ H > 0) (2)
Как сделать основную реакцию термодинамически вероятней побочной (увеличить теоретическую селективность)?
Что можно еще предпринять для увеличения равновесного выхода целевых продуктов?
Ответ: Обе реакции обратимы. Основная реакция идет с выделением тепла. Для смещения ее равновесия необходимо понизить температуру. Побочная реакция идет с поглощением тепла, поэтому понижение температуры смещает ее равновесие влево. Побочная реакция идет с увеличением числа молей вещества. Увеличение давление также сместит ее равновесие влево. Изменение давления не влияет на основную реакцию. Также для первой реакции можно использовать селективный катализатор.
41. Парокислородная конверсия метана протекает в шахтном конверторе и описывается реакциями:
СН4 + Н2О ↔ СО + 3 Н2 ∆ Н > 0
CH4 + 0,5 О2 → СО + 2 Н2 ∆ Н < 0
За счет чего реализуется принцип наилучшего использования энергии?
Какие источники энергии существуют внутри химико-технологических систем?
Ответ: В данном процессе используются несколько приемов для реализации ПНИЭ:
1. Совмещение тепловых эффектов основных реакций – в трубчатом реакторе (трубчатой печи) протекание эндотермической реакции обеспечивается в основном за счет экзотермической реакции, идущей параллельно (и частично за счет сжигания газа в межтрубном пространстве).
2.Использование теплоты сгорания метана на второй ступени конверсии в шахтном конвертере.
3. Создание энерготехнологической системы – высокая температура выходящих газов используется для производства водяного пара высокого давления, используемого затем для привода компрессоров.
Источники теплоты в ХТС:
1. Теплота экзотермических реакций
2. Высокая температура, при которой проводят эндотермические процессы
3. Горючие вещества, получающиеся в процессе нефтехимического синтеза
41.Какие приемы можно использовать для увеличения селективности при протекании последовательных побочных реакций в химической системе:
A + B → R, R → S?
Какие приёмы применяют для реализации принципа наилучшего использования сырья в случае протекания побочных реакций?
Ответ: В случае данной схемы процесса, в зависимости от конкретных веществ и характера реакции, можно использовать следующие подходы:
1. Введение или выбор катализатора. Катализатор, как правило, ускоряет только одну (целевую) реакцию, таким образом увеличивая селективность.
2. Применение одного из реагентов в избытке. Это ускоряет основную реакцию, увеличивает её выход, а, следовательно, и селективность. Избыток можно возвращать в рецикл. Необходимо отметить, что избыток реагента улучшает многие другие показатели процесса – например, бережет катализатор, уменьшает температуру и т.д.
3. Особый случай избытка – ступенчатая подача реагентов. В этом случае суммарные количества реагентов будут стехиометрическими, но на каждом этапе проведения процесса вводят избыток того или другого реагента:
для суммарной реакции aA+bB=rR при использовании 2 ступеней:
nA+pB=R+(B)изб m+n=a
mA+qB=R+(A)изб p+q=b
4. Подбор условий ведения процесса, при которых подавляются побочные реакции. Это может быть изменение температуры, давления, времени контактирования, вывод продукта из среды реакции, увеличение концентрации реагентов – в зависимости от побочной реакции.
5. Закалка системы – резкое уменьшение температуры системы в наиболее выгодном состоянии для ведения процесса.
Помимо перечисленных, для реализации ПНИС применяется еще ряд приемов:
- Смещение равновесия
- Противоток
- Совмещение процессов (комплексное использование сырья, переработка отходов)
43. С какой целью синтез метанола проводят с большими объемными скоростями? Что необходимо предусмотреть при выборе оптимальной объемной скорости?
CO+ 2H2  CH3OH
CH3OH  H>0
H>0
Ответ: Условия проведения процесса:
Исходя из термодинамики и кинетики процесса выбирают условия его проведения на соответствующих катализаторах. Так, в промышленных условиях на цинк-хромовых катализаторах процесс ведут под давлением 25—70 мПа, при температуре 370—420 °С, объемной скорости подачи газовой смеси-10000 -35000 с-1(т.е. время контактирования 10000 -35000 с) и мольном соотношении Н2:СО=(1,5—2,5):1. Обычно исходный газ содержит 10—15% инертных примесей. В связи с этим требуется непрерывный вывод части рецикла газовой смеси (примерно10%) из системы. В этих условиях конверсия СО за один проход составляет 5—20% при выходе метанола 85—87% от стехиометрического. Непревращенный газ возвращается в реактор после конденсации метанола и воды. Одновременно с метанолом образуется ряд побочных продуктов: диметиловый эфир, высшие спирты и др.
При работе на низкотемпературных медьсодержащих катализаторах давление поддерживается в пределах 3—5 мПа, температура—230—280 °С, объемная скорость 8000—12000 ч-1, мольное соотношение Н2:СО=(5—7):1. Обязательным условием успешной работы низкотемпературных катализаторов является присутствие в газовой смеси 4—5% (об.) диоксида углерода. Он необходим для поддержания активности таких катализаторов.
При циркуляционном процессе для его интенсификации и уменьшения количества побочных продуктов повышают объёмную скорость подачи сырья.
При более активном катализаторе возможны и более высокие скорости.При этих условиях процесс – сложный, обратимый несмещенный, гетерогенный каталитический.
44. В исследуемой системе в газовой фазе протекают основная (1) и побочная (2) реакции, которые обратимы в широком диапазоне температур:
А + 2В↔ C + D (∆H > 0) (1), C + A ↔ 2 R (∆ H < 0) (2)
В каких условиях надо проводить процесс для получения максимальной селективности образования продуктов основной реакции?
Обосновать выбор. Какие еще способы смещения равновесия можно использовать в данном случае?
Ответ: Необходимо получить максимальную селективность образования основной реакции
Селективность (избирательность) - SiA - отношение количества полученного целевого продукта ni (моь) к теоретически возможному его количеству ni теор (моль) при данной степени превращения исходного реагента

Где А – индекс, обозначающий исходное вещество, по которому рассчитывается селективность
i – индекс, обозначающий продукт реакции, для которого ведется расчет
Селективность показывает долю полезно израсходанного на целевой продукт сырья.
Таким образом, для повышения селективности образования целевых продуктов необходимо уменьшить выход продукта в побочной реакции.
Для этого нужно сместить равновесие в левую сторону согласно принципу Ле –Шателье.
1. реакция экзотермическая и идет с выделением тепла, следовательно для смещения равновесия в сторону исходных веществ нужно повысить температуру.
2. можно повысить концентрацию R, не выводя продукт из реакционной зоны
3. повышение или понижение давления не влияет на протекание процесса, так как число молей реагентов эквивалентно числу молей продукта
Кроме того, необходимо обеспечить смещение равновесия основной реакции в сторону образования продуктов. Для этого:
1. нужно повысит температуру, так как реакция идет с поглощением тепла
2. так как число молей реагентов превышает число молей продуктов, необходимо повысить давление для смещения равновесия вправо
3. по той же причине ( n<0) можно ввести инертный разбавитель для уменьшения накопления примесей в системе
n<0) можно ввести инертный разбавитель для уменьшения накопления примесей в системе
При полном расходовании реагентов в основной реакции побочная реакция протекать не будет, следовательно процесс будет идти с максимальной селективностью по целевым продуктам.
45. Первая стадия производства бутадиена – дегидрирование бутана
С4Н10 ↔ С4 Н8 + Н2 (∆ Н > 0) осложнена крекингом бутана
С4Н10↔ С2Н4 + С2Н6 (∆ Н > 0)
Энергия активации крекинга бутана имеет более высокое значение. Что можно предпринять для повышения селективности процесса?
Ответ: Поскольку E2 > E1, то для увеличения селективности процесса необходимо уменьшать температуро, но это приведет к уменьшению скорости процесса.
Также обе реакции, и главная и побочная являются эндодтермическим, а это значит, сто снижение температуры приведет к смещению равновесия влево (уменьшению выхода продукта, снижению селективности)
Поэтому для увеличения селективности необходимо вводить селективный катализатор, понижая таким образом E2
46. В газовой фазе протекают параллельные реакции: А → R (∆Н > 0) (основная) и 2 А → S (∆H < 0) (побочная). Энергия активации основной реакции Е1 больше, чем побочной Е2, а порядок реакции по компоненту А для первой реакции меньше, чем для второй. Как увеличить дифференциальную селективность процесса?
Какие приёмы Вы можете предложить для подавления побочных реакций?
Ответ: Т. к. E2>E1, то для увеличения селективности процесса необходимо уменьшать температуру, но это приведет к уменьшению скорости процесса.
Основная реакция является эндотермической, это значит, что снижение температуры приведет к смещению равновесия влево (уменьшение выхода основного продукта, снижение селективности)
Для увеличения селективности необходимо вводить селективный катализатор, понижающий E2
С6Н5СН2СН3 ↔ С6Н5СН =СН2 + Н2 (∆ Н >0)
сопровождается параллельными и последовательными реакциями распада и конденсации, энергии активации которых больше энергии активации основной реакции. Каким образом можно повысить селективность процесса?
Ответ: Для ускорения основной реакции необходимо использовать селективный катализатор. Для уменьшения влияния последовательных реакций необходимо ументшить время контактирования. По принципу Ле-Шателье: необходимо понизить температуру и давление.
47. В процессе пиролиза нефтепродуктов целевые реакции распада углеводородов осложнены реакциями конденсации, порядок которых выше порядка реакций распада. Как следует изменить условия процесса для увеличения доли реакций распада? Обосновать ответ.
Ответ: Пиролиз t=700-1000°C, P»1атм. Глубину процесса пиролиза определяют температура и давление. Для пиролиза благоприятна высокая температура, так с увеличением температуры растет выход этилена и пропилена (целевые продукты.). Процесс желательно проводить при пониженном давлении Р=0,03-0,12МПа. Чтобы снизить парциальное давление углеводородов, сырье разбавляют водяным паром. При разбавлении сырья водяным паром значительно возрастает выход этилена, уменьшается коксообразование на стенках труб и увеличивается скорость движения газосырьевой смеси в печи.
49. Какие приемы применяют в процессе окисления SO2+0,5O2↔SO3 (Δ;Н<0) для реализации принципа наилучшего использования сырья? Какие еще приемы используются для реализации этого принципа?
Ответ: Для реализации принципа наилучшего использования сырья процесс окисления SO2+0,5O2=SO3 ведется с избытком О2, т.к. процесс обратимый, экзотермический, проводят его по линии оптимальных температур.
Принцип наилучшего использования сырья включает:
1) использование реагента в избытке
2) смещение равновесия
3) "закалка" системы в состоянии наиболее выгодном для проведения процесса
Используется
- в обратимых эндотермических реакциях (при охлаждении увеличивается скорость обратной реакции)
- при протекании последовательной побочной реакции
- при наличии обратимых полиморфных превращений
4) использование противотока в системе (способствует более глубокому взаимодействию реагентов в системе)
5) подавление побочных реакций
Увеличение скорости основной реакции относительно протекающих побочных
- селективный катализатор
- избыток реагента
- уменьшение времени пребывания или увеличение объемной скорости
- вывод продукта из сферы реакции
6) совмещение (комбинирование) процессов
- постадийное
- комплексное использование сырья
- использование отходов
50. Для чего необратимую гетерогенную экзотермическую реакцию в системе «газ-твердое тело»:
А(г) + В(т) → R(г) + S (т)
проводят с избытком реагента А? Обосновать ответ. Какие приёмы применяются для реализации принципа наибольшей интенсивности процесса в гетерогенных системах?
Ответ: Для интенсификации процесса используют избыток реагента А. Избыток реагента увеличивает скорость как химической реакции, так и процессов массопередачи и подавляет побочные реакции.
Приемы для реализации принципа набольшей интенсивности процесса:
Для увеличения движущей силы процесса используют
- увеличение концентрации реагирующих веществ.
- увеличение давления с участием газовой фазы
- вывод продукта из сферы реакции
- проведение процесса вдали от состояния равновесия (с большими объемными скоростями или малым временем контактирования)
51. Какие системы называют энерготехнологическими и каковы приёмы рационального использования энергии внутри ХТС?
Ответ: Энерготехнологические системы – системы, в которых наряду с продуктом производится энергия.
Приемы рационального использования энергии внутри ХТС:
- Производство пара в котлах-утилизаторах (парогенераторах);
- Использование энергетического потенциала промежуточных потоков ХТС.
52. Какие основные технологические принципы реализуются одновременно при применении рециркуляции исходных реагентов?
Ответ: Рециркуляция исходных реагентов связана с неполнотой их превращения.
Причинами рециркуляции могут быть:
· избыток реагента
· ограниченное время контактирования (для предотвращения побочных процессов)
· малая скорость (проводят процесс вдали от состояния равновесия, а непрореагировавшие вещества возвращают в процесс, при этом повышается интенсивность процесса, т.е. повышается производительность)
· термодинамические ограничения (синтез NH3)
Рассмотрим принципы:
- принцип наилучшего использования сырья – реализуется (в результате рецикла повышается степень превращения сырья)
- принцип наилучшего использования энергии – нет
- принцип наибольшей интенсивности процесса – реализуется (маленькое время контактирования – большая объемная скорость→большая интенсивность I=a*W)
- принцип экологической безопасности – реализуется (меньше отходов)
- принцип технологической соразмерности – реализуется
54. Какие основные технологические принципы реализуются одновременно при применении оптимальных больших объемных скоростей?
Ответ: 1) принцип наибольшей интенсивности процесса, т.к. увеличивается движущая сила процесса из-за того, что концентрация продукта не успевает достигнуть равновесного значения и поэтому процесс ведется вдали от равновесия.
Интенсивность процесса  , где а – мольная доля продукта, w – объемная скорость (расход потока/единицу объема аппарата).
, где а – мольная доля продукта, w – объемная скорость (расход потока/единицу объема аппарата).
2) принцип наилучшего использования сырья, так как позволяет подавить побочные реакции, ведь уменьшается время пребывания реагента в системе.
55. Какие приемы применяют при абсорбции нитрозных газов в процессе производства азотной кислоты для увеличения движущей силы?
Ответ: Абсорбции нитрозных газов является завершающим этапом производства азотной кислоты и состоит из двух процессов:
1) хемосорбции диоксида азота водой:
2NO2 + H2O ↔ HNO3 + HNO2 ΔH<0
2) превращением азотистой кислоты в азотную:
3HNO2 ↔ HNO3 + 2NO + H2O ΔH>0
Кинетика процесса хемосорбции в системе газ-жидкость (абсорбция с химическим взаимодействием) описывается уравнением:
 ,
,
где Кабс – константа абсорбции, F – поверхность контакта,  – парциальное давление в газе на абсорбцию,
– парциальное давление в газе на абсорбцию, 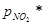 - парциальное давление над поглощающей жидкостью. Разность
- парциальное давление над поглощающей жидкостью. Разность  равна движущей силе процесса хемосорбции.
равна движущей силе процесса хемосорбции.
Для увеличения движущей силы процесса абсорбции необходимы:
- высокая концентрация NO2 в газе, поступающем на абсорбцию
- понижение температуры, так как процесс абсорбции экзотермический
- организация противотока газа и абсорбирующей воды.
Какие приемы используют в гетерогенных системах для реализации принципа наибольшей интенсивности процесса?
Скорость гетерогенного процесса:
 ,
,
где k – коэффициент интенсивности процесса, F – поверхность контакта фаз, с - текущая концентрация регента, с* - равновесная концентрация реагента, Δ – движущая сила процесса.
Для увеличения интенсивности процесса, т.е. для его ускорения необходимо:
- увеличить поверхность контакта фаз, например, использовать более мелкие частицы катализатора,
- увеличить движущую силу процесса, например, увеличить объемную скорость процесса, тем самым отодвинув текущую концентрацию от равновесной, или просто увеличить концентрацию реагента в потоке,
- увеличить температуру протекания процесса, если процесс проходит в кинетической области, тогда коэффициент эффективности равен константе скорости реакции  или ввести катализатор, уменьшив тем самым энергию активации реакции.
или ввести катализатор, уменьшив тем самым энергию активации реакции.
- если процесс протекает во внешнедиффузионной области, то следует увеличить линейную скорость потока, турбулизировать поток.
56. Какой из технологических приемов позволяет одновременно реализовать принципы наибольшей интенсивности процесса, наилучшего использования сырья, технологической соразмерности процесса и экологической безопасности?
Ответ: селективный катализатор, т.к.:
ускоряет реакцию (ПНИП);
ускоряет только основную реакцию, обеспечивая более полное ее протекание (ПНИС);
позволяет разрешить противоречия, возникающие во время процесса (например, реакция экзотермическая - необходимо понижать температуру процесса, но для высокой скорости процесса необходимо повышать температуру. Противоречие разрешается путем введения катализатора - ПТСП);
в связи с более полным протеканием основной реакции уменьшается количество отходов (ПЭБП).
57. При производстве серной кислоты на последней стадии – абсорбции – протекает реакция:
SO3+H2O=H2SO4,?H= -92 кДж.
Чем орошают абсорбер?
В чем противоречие ПНИП? Каковы способы увеличения движущей силы процесса?
Ответ: орошение проводят 98.3% серной кислотой, т.к. при орошении абсорбера водой возможно резкое увеличение температуры (реакция сильно экзотермична, а введение дополнительного количества реагента в сферу реакции сместит ее вправо. Увеличится т-ра, возможно образование сернокислотного тумана)
Противоречие ПНИП: мы умышленно уменьшаем движущую силу процесса, вводя продукт в сферу реакции.?= pSO3- p* SO3. Надо орошать тем соединением, над которым p* SO3 min (над водой=0)
Увеличиваем движущую силу процесса, организуя противоток в системе.
58. Какими приемами увеличивают движущую силу процесса (принцип наибольшей интенсивности процесса)? Какие еще приемы применяются для реализации принципа наибольшей интенсивности процесса?
Ответ: Для увеличения движущей силы процесса
1) увеличивают концентрацию реагирующих веществ
2) увеличивают давление с учетом газовой фазы
3) выводят продукт из сферы реакции
4) проводят процесс вдали от состояния равновесия (с большими объемными скоростями или малым временем контактирования)
увеличение объемной скорости также является способом интенсификации технологического процесса,
направление потоков (прямоток, противоток или смешанный ток)
59. Каталитическую конверсию оксида углерода водяным паром:
СО + Н2О ↔ СО2 + Н2 ∆Н = - 36,6 кДж/моль
проводят в две стадии, используя сначала высоко-, а затем низкотемпературные катализаторы. К каким изменениям расхода водяного пара это приводит по сравнению с одноступенчатым процессом?
Ответ: СО + Н2О ↔ СО2 + Н2 ∆Н = - 36,6 кДж/моль – основная реакция; 2СО ↔ С + СО2 – побочная реакция. При одноступенчатом процессе для подавления побочной реакции увеличивают скорость основной путем проведения процесса с избытком водяного пара, при этом увеличивается и конверсия. При двух стадийном способе на высокотемпературном катализаторе (Fe3O4 + Cr2O3, t = 400 – 500°C) селективно достигается большая скорость основной реакции, на низкотемпературном катализаторе (CuO + ZnO + Cr2O3, t ≈ 250°C) достигается большая конверсия. Таким образом, подавление побочной реакции производится с помощью высокотемпературного катализатора, поэтому расход водяного пара можно уменьшить.
60. Какие приёмы используют для подавления побочных реакций и повышения селективности?
Ответ: Рассмотрим параллельную реакцию:
a1A → rR – основная реакция;
a2A → sS – побочная реакция.
Константа скорости основной реакции – k1, побочной реакции – k2.
Для подавления побочной реакции и повышения селективности нужно увеличивать скорость образования целевого продукта R по отношению к скорости образования побочного S. Для этого применяют следующие способы:
1) Влияние концентраций исходного реагента.
Пусть t = const, целевая реакция имеет по исходному реагенту А порядок n1, а побочная реакция – n2.
Если n1>n2, то увеличение скорости образования целевого продукта по сравнению со скоростью образования побочного достигается за счет использования исходного реагента высокой концентрации.
Если n1<n2, то скорость образования целевого продукта по отношению к скорости образования побочного будет больше при использовании исходного реагента низкой концентрации.
Если n1=n2, то скорости образования целевого и побочного продуктов остаются постоянными при любых значениях концентрации исходных реагентов, их изменить в этом случае можно, лишь изменив k1 и k2. Это можно сделать за счет изменения температуры проведения реакции.
2) Влияние температуры проведения процесса.
Пусть n1=n2, энергия активации целевой реакции Е1, побочной Е2.
Если Е1>Е2, то с ростом температуры быстрей увеличивается скорость целевой реакции по отношению к скорости побочной.
Если Е1<Е2, то для более быстрого увеличения скорости основной реакции по отношению к скорости побочной температуру проведения процесса нужно уменьшать.
3) Влияние катализаторов.
Катализаторы применяют для уменьшения энергии активации реакции.
Пусть t = const, тогда при снижении энергии активации основной реакции с помощью селективного катализатора увеличивается k1 по сравнению с k2, поэтому увеличивается скорость образования целевого продукта по отношению к скорости образования побочного.
61. Что такое последовательные связи в ХТС и для чего их используют?
Какие ещё типы связей используются в ХТС и их назначение?
Ответ: Последовательная схема применяется для увеличения степени использования сырья и увеличения эффективности функционирования подсистем разделения.
Другие типы связей в ХТС
1. Параллельная – характеризуется наличием разветвлений в ХТС, при этом они имеют общий вход и выход. Применяется для резервирования мощностей при комплексном использовании сырся, при переработке одного вида сырья в различные химические формы.
2. Последовательно-обводная (байпас). Применяется для регулирования температуры экзотермического процесса
3. Перекрестные.
Все эти связи характеризуются однонаправленностью потоков.
62. Что такое байпасные связи в ХТС и для чего их используют?
Какие ещё типы связей используются в ХТС и каково их назначение?
Ответ: Байпас применяется для регулирования температауры экзотермического процесса. Это последовательная обводная связь, при которой часть потока минует аппарат. Используется в колнке синтезха аммиака и метанола.
В ХТС существуют другие типы связей:
1. Параллельная – характеризуется наличием разветвлений в ХТС, при этом они имеют общий вход и выход. Применяется для резервирования мощностей при комплексном использовании сырся, при переработке одного вида сырья в различные химические формы.
2. Перекрестные.
3. Последовательная схема применяется для увеличения степени использования сырья и увеличения эффективности функционирования подсистем разделения.
63. Для чего используется обратная связь(рецикл) в ХТС? Что является причиной рециркуляции исходных реагентов?
Ответ: Обратная связь(рецикл) в ХТС используется для регулирования температуры, концентрации компонентов в смесях,увеличения выхода целевого вещества, а также для увеличения селективности. Рецикл используется для реализации принципа наилучшего использования сырья.
Схема рецикла ХТС.
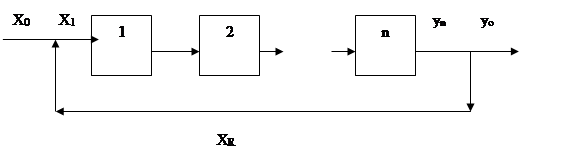
Внутренний технический поток ХR направление которого противоположно главному потоку называется рециклом.
R- это степень рециркуляции. R показывает какая часть главного потока возвращается в процесс.

Кратность рециркуляции КR показывает во сколько раз главный поток больше прямого:
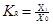
В ХТС могут циркулировать исходные, промежуточные и конечные вещества.
Причиной рециркуляции исходных реагентов является неполное их превращение:
1)Термодинамические ограничения (несмещаемость процесса).
2)Малая скорость реакции (есть смысл работать в дали от состояния равновесия и возвращать исходное вещество на рецикл с целью увеличения производительности).
3)Ограниченное время контактирования.
4)Избыток реагентов (при синтезе метанола избыток Н2)
|
|
Дата добавления: 2015-04-24; Просмотров: 1445; Нарушение авторских прав?; Мы поможем в написании вашей работы!