
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос 28. Строение многоэлектронных атомов
|
|
|
|
Строение многоэлектронных атомов. Принцип наименьшей энергии. Принцип Паули. Правило Хунда. Правило Клечковского. Электронные и электронно-графические формулы атомов элементов в основном и возбужденном состоянии.
(дополнение)
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто.
Квантово-механические расчеты показывают, что в многоэлектронных энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни).
Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей.
Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули (принцип Паули):
В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином).
Используя понятия квантовые числа можно сказать, что:
Каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел - главногоn,орбитального l, магнитного m l, и спинового ms.
Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу:
В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии).
Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательно квантовое возрастание энергии подуровней происходит в следующем порядке: 1s - 2s -2р - 3s – 3р - 4s –3d - 4р - 5s -….
Такой порядок увеличения энергии подуровней определяет расположение эле Ментов в Периодической системе.
Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927г) (правило Хунда):
При данном значении квантового числа l (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов.
Порядок возрастания энергии атомной орбитали в сложных атомах описывается правилом Клечковского: энергия атомной орбитали возрастает в соответствии с увеличениемn +l главного и орбитального квантовых чисел. При одинаковом значении суммы энергия меньше у атомной орбитали с меньшим значением главного квантового числа.
Распределение электронов по различным атомным орбиталям называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям.
Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронно-графических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например. Для основного состоянии атома водорода электронная формула: 1s1.
Более полно строение электронных подуровней можно описать с помощью электронографических диаграмм, где распределение электронов по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны обозначают стрелками или ¯ в зависимости от знака спинового квантового числа.
С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s –элементы, р-элементы, d-элементы, f-элементы.
13. ядерная или планетарная модель строения атома Резерфорда-
Модель атома Резерфорда (Ядерная или Планетарная модель атома)
Рассеяние отдельных α-частиц на большие углы Резерфорд объяснил тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10-10 м, как предполагали ранее, а сосредоточен в центральной части атома (атомном ядре) в области значительно меньших размеров. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию α-частиц нужно принять радиус атомного ядра равным 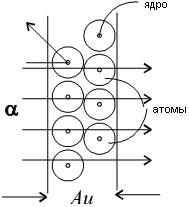 примерно 10-15 м.
примерно 10-15 м.
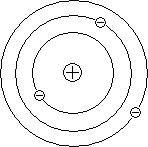
Резерфорд предположил, что атом устроен подобно планетарной системе. Как вокруг Солнца на больших расстояниях от него обращаются планеты, так электроны в атоме обращаются вокруг атомного ядра. Радиус круговой орбиты самого далекого от ядра электрона и есть радиус атома. Такая модель атома была названа планетарной моделью.
Планетарная модель атома объясняет основные закономерности рассеяния заряженных частиц.
Так как большая часть пространства в атоме между атомным ядром и обращающимися вокруг него электронами пуста, быстро заряженные частицы могут почти свободно проникать через довольно значительные слои вещества, содержащие несколько тысяч слоев атомов.
При столкновениях с отдельными электронами быстрые заряженные частицы испытывают рассеяние на очень большие углы, так как масса электрона мала. Однако в тех редких случаях, когда быстрая заряженная частица пролетает на очень близком расстоянии от одного из атомных ядер, под действием силы электрического поля атомного ядра может произойти рассеяние заряженной частицы на любой угол до 180°.
14. Периодический закон Д.И. Менделеева и его современная формулировка.
Формулировка периодического закона, данная Д.И. Менделеевым, гласила: свойства химических элементов находятся в периодической зависимости от атомных масс этих элементов. Современная формулировка гласит: свойства химических элементов находятся в периодической зависимости от заряда ядра этих элементов. Такое уточнение потребовалось, поскольку к моменту установления Менделеевым периодического закона еще не было известно о строении атома. После выяснения строения атома и установления закономерностей размещения электронов по электронным уровням стало ясно, что периодическая повторяемость свойств элементов связана с повторяемостью строения электронных оболочек.
15. На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов, которая состояла из 7 периодов и 8 групп (короткопериодный вариант таблицы). В настоящее время чаще используется длиннопериодный вариант Периодической системы (7 периодов, 8 групп, отдельно показаны элементы - лантаноиды и актиноиды).
Периоды - это горизонтальные ряды таблицы, они подразделяются на малые и большие. В малых периодах находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды), в больших периодах - 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Каждый период начинается с типичного металла, а заканчивается неметаллом (галогеном) и благородным газом.
Группы - это вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Короткопериодный вариант Периодической системы включал подгруппы элементов (главную и побочную).
Подгруппа - это совокупность элементов, являющихся безусловными химическими аналогами; часто элементы подгруппы обладают высшей степенью окисления, отвечающей номеру группы.
16.Изменение кислотно-основных и окислительно-восстановительных свойств в группах и периодах ПС
В пределах периодов слева направо свойства оксидов элементов изменяется плавно от основных к кислотным
В пределах одной группы (сверху вниз) основные свойства оксидов возрастают, кислотные убывают
Вопрос 17. Диагональ от водорода к радону примерно делит все элементы на металлы и неметаллы, при этом неметаллы находятся выше диагонали. (К неметаллам относят 22 элемента – H, B, C, Si, N, P, As, O, S, Se, Te, галогены и инертные газы, к металлам – все остальные элементы.) Вдоль этой линии располагаются элементы, которые обладают некоторыми свойствами металлов и неметаллов (металлоиды – устаревшее название таких элементов). При рассмотрении свойств по подгруппам сверху вниз наблюдается увеличение металлических свойств и ослабление неметаллических свойств. Окисление[править | править исходный текст]
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление[править | править исходный текст]
Основная статья: Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
18. Периодичность изменения свойств элементов.Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
Так как электронные конфигурации атомов элементов изменяются периодически, то соответственно периодически изменяются и свойства элементов, которые определяются их электронным строением: размерами атомов, энергетическими характеристиками, окислительно-восстановительнымим свойствами.
Главным химическим свойством атомов элементов является их окислительная или восстановительная способность, которая определяется положением элемента в ПСЭ. В периодах от начала к концу ослабляется восстановительная активность атомов и возрастает окислительная, т. е. наблюдается переход от атомов с типичными свойствами металлов к атомам с типичными свойствами неметаллов, электроотрицательность атомов при этом возрастает. В пределах группы элементов (главной подгруппы) с ростом заряда ядра атомов увеличивается количество энергетических уровней атомов. Таким образом, восстановительная активность атомов по группам сверху вниз возрастает, а окислительная – снижается, уменьшается и величина ЭО атомов. Самые сильные окислители (неметаллы) находятся в правом верхнем углу ПСЭ: F, Cl, O. Самые сильные восстановители (металлы) находятся в левом нижнем углу: Fr, Ba, Ra.
Способность вещества вступать в ту или иную химическую реакцию и реагировать с меньшей или большей скоростью называют его реакционной способностью.
Реакционную способность органического вещества всегда нужно рассматривать только по отношению к конкретному реакционному партнеру. Само вещество при этом называют субстратом, а действующее на него вещество (реакционную частицу) - реагентом. Субстратом, как правило, называют то вещество, в котором у атома углерода происходит разрыв старой и образование новой связи.
В ходе химической реакции обычно затрагивается не вся молекула, а только ее реакционный центр, т. е. атом или группа атомов, непосредственно участвующие в данной реакции.
19. Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
 Первый способ: Электроны легко можно распределить по подуровням исходя из некоторых правил. Во первых нужна цветная таблица. Представим каждый элемент как один новый электрон, Каждый период – это соответствующий уровень, s.p-электроны всегда в своём периоде, d-электроны на уровень ниже (3 d-электроны в гостях в 4-ом периоде), f-электроны на 2 уровня ниже. Просто берём таблицу и читаем исходя из цвета элемента, у s, p- элементов номер уровня соответствует номеру периода, если доходим до d-элемента пишем уровень на один меньше, чем номер периода, в котором этот элемент находится (если элемент в 4-м периоде, следовательно, 3 d). Также поступаем и с f-элементом, только уровень указываем меньше чем номер периода на 2 значения (если элемент в 6-м периоде, следовательно, 4 f).
Первый способ: Электроны легко можно распределить по подуровням исходя из некоторых правил. Во первых нужна цветная таблица. Представим каждый элемент как один новый электрон, Каждый период – это соответствующий уровень, s.p-электроны всегда в своём периоде, d-электроны на уровень ниже (3 d-электроны в гостях в 4-ом периоде), f-электроны на 2 уровня ниже. Просто берём таблицу и читаем исходя из цвета элемента, у s, p- элементов номер уровня соответствует номеру периода, если доходим до d-элемента пишем уровень на один меньше, чем номер периода, в котором этот элемент находится (если элемент в 4-м периоде, следовательно, 3 d). Также поступаем и с f-элементом, только уровень указываем меньше чем номер периода на 2 значения (если элемент в 6-м периоде, следовательно, 4 f).
Второй способ:
Можно рассмотреть порядок заполнения уровней и подуровней электронами, используя понятия основного принципа - принципа наименьшего запаса энергии: наиболее устойчиво состояние атома, при котором его электроны имеют наименьшую энергию.
Т.е. основываясь на Запрете Паули, Правилах Хунда и Клечковского
Запрет Паули: в атоме не может быть двух электронов, четыре квантовых числа которых одинаковы (т.е. каждая атомная орбиталь не может быть заполнена более чем двумя электронами, причем с антипараллельными спинами.)
Правило Хунда: электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарное спиновое число их было максимальным, т.е. наиболее устойчивому состоянию атома соответствует максимально возможное число неспаренных электронов с одинаковыми спинами.
Правила Клечковского: А) Заполнение электронных слоев электронами начинается с уровней и подуровней, обладающими самыми низкими значениями n и l, и идет в порядке возрастания n+l;
Б) Если для двух орбиталей сумма n+l окажется одинаковой, то в первую очередь электронами заполняется орбиталь с меньшим значением n.
Первый случай не показывает последовательность заполнения подуровней, а второй- требует время для построения таблицы.
Последовательность заполнения атомных электронных орбиталей в зависимости от значений главного и орбитального квантовых чисел была исследована советским ученым В. М. Клечковским, который установил, что энергия электрона возрастает по мере увеличения суммы этих двух квантовых чисел, т. е. величины (п + 1). в соответствии с этим, им было сформулировано следующее положение (первое правило Клечковского): при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшей суммой главного и орбитального квантовых чисел (п + 1) к орбиталя с большим значением этой суммы.
«Провал» электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
20.Ряд переходных металлов в ПС Менделеева. | - элементы и особенности их электронного строения
Переходные элементы, переходные металлы, химические элементы I б — VIII б подгрупп периодической системы элементов Д. И. Менделеева. Особенность строения атомов П. э. заключается в незавершённости их внутренних электронных оболочек; соответственно различают d -элементы, у которых происходит заполнение 3d-, 4d-, 5d- и 6d- подоболочек, и f -элементы, у которых заполняется 4 f -подоболочка (лантаноиды) и 5 f -подоболочка (актиноиды). Такое строение электронных оболочек определяет некоторые специфические свойства П. э. (способность к комплексообразованию, ферромагнетизм и др.). Общее число П. э. составляет 61.
21.Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества.
Электpоoтрицательность χ (греч. хи) — способность атома удерживать внешние (валентные) электроны. Она определяется степенью притяжения этих электронов к положительно заряженному
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
вопрос 21. По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее. Электроотрицательность: с лева направо увеличивается, сверху вниз уменьшается.
Энергия ионизации: слева направо увеличивается, сверху вниз уменьшается.
Сродство к электрону: слева направо увеличивается, сверху вниз уменьшается. Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As):
вопрос 22 Правило октета (октетная теория) — предложено Г. Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. По своей важности это фундаментальное открытие Льюиса стоит в одном ряду с такими открытиями, как Периодический закон элементов и теория строения органических соединений. Широко распространенное мнение, что правило октета выполняется лишь в ограниченном числе случаев также ошибочно, как и утверждение того, что Периодический закон элементов не имеет всеобщего характера. Все примеры «невыполнения» правила октетов можно подразделить на следующие три группы:
1. Сумма валентных электронов атомов, образующих молекулу, нечётна. Пример — молекула оксида азота NO.
2. Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Аналогичные трехцентровые, но двухэлектронные связи присутствуют в молекуле B2H6.
3. В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, то есть в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов
Таким образом, главным в правиле октетов Льюиса является не цифра 8 (или 18), а обобществление электронов как основа образования ковалентной химической связи, и приближение за счет этого к электронной конфигурации инертного газа — восьмиэлектронной или восемнадцатиэлектронной.
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
Вопрос 24 Ковалентная связь - это химическая связь, образующаяся за счет общих электронных пар. Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
Вопрос 25 Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.[1] Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких взаимодействий являются комплексы RA-H···BR′ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR′.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность[2], её распространенность и важность, особенно в органических соединениях[3], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H···[F-H···F]-).
Вопрос 26 Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора.
Ко́мплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения, имеющие внешнюю сферу, в водном растворе полностью диссоцируют на комплексный малодиссоцирующий катион ([Ag(NH3)2]+) или анион ([Fe(CN)6]3−). Комплексные соединения без внешней сферы в воде нерастворимы (например, карбонилы металлов).
Комплексные соединения разнообразны и многочисленны.
Вопрос 27 Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, происходящие из атомов металлов от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции.
ЭЛЕКТРОННЫЙ ГАЗ- совокупность электронов проводимости в кристалле или плазме, способных участвовать в образовании электрич. тока.
В основе зонной теории лежат следующие главные приближения[1]:
Твёрдое тело представляет собой идеально периодический кристалл.
Равновесные положения узлов кристаллической решётки фиксированы, то есть ядра атомов считаются неподвижными (адиабатическое приближение). Малые колебания атомов вокруг равновесных положений, которые могут быть описаны как фононы, вводятся впоследствии как возмущение электронного энергетического спектра.
Многоэлектронная задача сводится к одноэлектронной: воздействие на данный электрон всех остальных описывается некоторым усредненным периодическим полем.
Диэлектрики – вещества, обладающие малой электропроводностью, т.к. у них очень мало свободных заряженных частиц – электронов и ионов. Эти частицы появляются в диэлектриках только при нагреве до высоких температур. Существуют диэлектрики газообразные (газы, воздух), жидкие (масла, жидкие органические вещества) и твердые (парафин, полиэтилен, слюда, керамика и т.п.).
Полупроводники — это вещества, удельное сопротивление которых убывает с повышением температуры, наличием примесей, изменением освещенности. По этим свойствам они разительно отличаются от металлов. Обычно к полупроводникам относятся кристаллы, в которых для освобождения электрона требуется энергия не более 1,5—2 эВ. Типичными полупроводниками являются кристаллы германия и кремния, в которых атомы объединены ковалентной связью.
Проводни́к — вещество, хорошо проводящее электрический ток[1]; в таком веществе имеются свободные носители заряда, то есть заряженные частицы, которые могут свободно перемещаться внутри объёма вещества. Среди наиболее распространённых твёрдых проводников известны металлы, полуметаллы, углерод (в виде угля и графита). Пример проводящих жидкостей при нормальных условиях — ртуть, электролиты, при высоких температурах — расплавы металлов. Пример проводящих газов — ионизированный газ (плазма). Некоторые вещества, при нормальных условиях являющиеся изоляторами, при внешних воздействиях могут переходить в проводящее состояние, а именно проводимость полупроводников может сильно варьироваться при изменении температуры, освещённости, легировании и т. п.
вопрос 29. Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах.
Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи.
Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда).
Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярны.
Физический и вычислительный смысл дипольного момента состоит в том, что он дает поправки первого порядка (чаще всего — малые) в положение каждого заряда системы по отношению к началу координат (которое может быть условным, но приближенно характеризует положение системы в целом — система при этом подразумевается достаточно компактной). Эти поправки входят в него в виду векторной суммы, и везде, где при вычислениях такая конструкция встречается (а в силу принципа суперпозиции и свойства сложения линейных поправок — см.Полный дифференциал — такая ситуация встречается часто), там в формулах оказывается дипольный момент.
Электри́ческий ди́польный моме́нт — векторная физическая величина, характеризующая, наряду с суммарным зарядом (и реже используемыми высшими мультипольными моментами), электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ею поля и действия на нее внешних полей. Главная после суммарного заряда и положения системы в целом (ее радиус-вектора) характеристика конфигурации зарядов системы при наблюдении ее издали.
Вопрос 30 Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами.
Бывает электростатическим и донорно-акцепторным. Агрегатные состояния вещества (от латинского aggrego — присоединяю, связываю) — это состояния одного и того же вещества, переходам между которыми соответствуют скачкообразные изменения свободной энергии, энтропии, плотности и других физических параметров вещества.
Газ (французское gaz, происшедшее от греческого chaos — хаос) — это агрегатное состояние вещества, в котором силы взаимодействия его частиц, заполняющих весь предоставленный им объем, пренебрежимо малы. В газах межмолекулярные расстояния велики и молекулы движутся практически свободно.
Жидкость - это агрегатное состояние вещества, промежуточное между твердым и газообразным.
Аморфное твердое состояние вещества является разновидностью переохлажденного состояния жидкости и отличается от обычных жидкостей существенно большей вязкостью и численными значениями кинетических характеристик.
Кристаллическое твердое состояние вещества — это агрегатное состояние, которое характеризуется большими силами взаимодействия между частицами вещества (атомами, молекулами, ионами). Виды межмолекулярных взаимодействийОснову межмолекулярных взаимодействий составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых свойствах вещества проявляется усредненное взаимодействие, которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физических характеристик (дипольного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярного взаимодействия можно достаточно обоснованно подразделить на три вида - электростатические, поляризационные (индукционные) и дисперсионные. Электростатические силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризационными силами, если молекулы анизотропны.
Вопрос 31 Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. Размерность константы скорости реакции зависит от порядка реакции.[1] Если концентрация реагирующих веществ измерена в моль·л-1 (M):
Для реакции первого порядка, k имеет размерность с-1
Для реакции второго порядка, k имеет размерность л·моль-1·с-1 (или M-1·с-1)
Для реакции третьего порядка, k имеет размерность л2·моль-2·с-1 (или M-2·с-1)
Вопрос 32. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа), давление, площадь поверхности реагирующих веществ.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Уравнение, которое описывает это правило, следующее:
~V_2=V_1\cdot\gamma^{\frac{T_2-T_1}{10}}
где ~V_2 — скорость реакции при температуре ~T_2, ~V_1 — скорость реакции при температуре ~T_1, ~\gamma — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
3.Влияние концентрации реагирующих веществ.При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Вопрос 33 Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
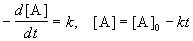 ,
,
где [A] - концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A  B скорость прямо пропорциональна концентрации:
B скорость прямо пропорциональна концентрации:
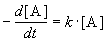 .
.
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a - x (t), где x (t) - концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
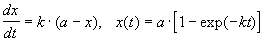 .
.
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
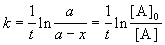 .
.
ПЕРИОД ПОЛУРАСПАДА, промежуток времени, в течение которого распадается половина данного количества ядер радиоактивного изотопа (которые превращаются в другой элемент или изотоп). Измеряется только период полураспада, так как полного распада не происходит. Период полураспада остается постоянным при любой температуре и давлении, но сильно отличается у разных изотопов.
Вопрос 36. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза. |
Уравнение, которое описывает это правило, следующее:
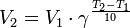
где 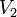 — скорость реакции при температуре
— скорость реакции при температуре 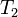 ,
, 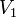 — скорость реакции при температуре
— скорость реакции при температуре 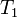 ,
, 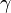 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
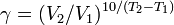
Вопрос 37. Уравне́ние Арре́ниуса устанавливает зависимость константы скорости 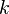 химической реакции от температуры
химической реакции от температуры 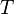 .
.
Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 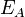 ), чтобы этот барьер преодолеть. Из распределения Больцманадля кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцманадля кинетической энергии молекул известно, что число молекул, обладающих энергией 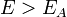 , пропорционально
, пропорционально 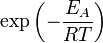 . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
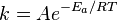
Здесь  характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул,  — универсальная газовая постоянная.
— универсальная газовая постоянная.
В рамках теории активных соударений  зависит от температуры, но эта зависимость достаточно медленная:
зависит от температуры, но эта зависимость достаточно медленная:
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений 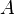 на 10 %.
на 10 %.
В рамках теории активированного комплекса получаются другие зависимости  от температуры, но во всех случаях более слабые, чем экспонента.
от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция.
Вопрос 38. Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Константа равновесия- величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия.
Смещение химического равновесия:
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняется закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы, влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении - в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении - в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции - в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Вопрос 40. Принцип Ле-Шателье:
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира)
Вопрос 41.) Химическая теория катализа, основанна на знаниях, полученных в ходе изучения элементарных химических реакций, как модельных (взаимодействие специально полученных химически активных частиц), так и при исследовании элементарных стадий сложных каталитических превращений.
КАТАЛИЗАТОРЫ-вещества, изменяющие скорость хим. реакцииции или вызывающие ее, но не входящие в состав продуктов.
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества.
ПОЧЕМУ КАТАЛИЗАТОР УСКОРЯЕТ ПРЕВРАЩЕНИЕ
Еще в XIX веке в поисках ответа на этот вопрос было высказано много разных предположений: фазовые превращения и уплотнение реагентов у поверхности катализаторов; передача энергии от катализатора; из- менение максвелл-больцмановского распределения по энергии. Эти факторы могут играть роль, но не всегда. В основу современных представлений положена идея образования в ходе превращения нового промежуточного соединения для получения которого требуется меньше энергии.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2616; Нарушение авторских прав?; Мы поможем в написании вашей работы!