
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень электролитической диссоциации
|
|
|
|
C
B
A
Сравнительная характеристика схем погашения кредита.
Финансовые отношения предприятия с банками.
Источники формирования финансовых ресурсов.
Функции финансов предприятия. Уровни финансовых отношений.
Понятие финансов и финансовых ресурсов. Структура финансовой системы.
Показатели рентабельности.
Источники получения прибыли.
Факторы, влияющие на прибыль, в т.ч. на прибыль от реализации продукции.
sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'.

| ––® | 
|
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
sp2- Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120°.

| ––® | 
|
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется s- связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется p- связь. Три sp2- орбитали могут образовывать три s- связи (BF3, AlCl3). Еще одна связь (p- связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).
Молекулы, в которых осуществляется sp2- гибридизация, имеют плоскую геометрию.
sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 180°.
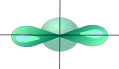
| ¾® | 
|
Две sp- орбитали могут образовывать две s- связи (BeH2, ZnCl2). Еще две p- связи могут образоваться, если на двух p- орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2).
Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
22. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный или частичный распад молекул растворенного в-ва на катионы и анионы. Электролитическойдиссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическаядиссоциация, как правило, происходит в полярных р-рителях. При электролитической диссоциации разрываются обычно лишь наиб. полярные связимолекул, напр. карбоновые к-ты RCOOH диссоциируют на  и Н+. Электролитической диссоциацией могут подвергаться молекулы нек-рых р-рителей, напр. воды.
и Н+. Электролитической диссоциацией могут подвергаться молекулы нек-рых р-рителей, напр. воды.
Осн. причинами электролитической диссоциации являются, с одной стороны, взаимод. растворенного в-ва с р-рителем, к-рое приводит ксольватации ионов, а с другой стороны - значит. ослабление электро-статич. взаимод. между сольватир. ионами в среде, обусловленное ее электростатич. полем (диэлектрич. проницаемостью р-рителя). При этом работа, необходимая для разрушения молекул (кристаллич. решетки), обеспечивается за счет энергии сольватации.
Электролитическая диссоциация лежит в основе деления р-ров на два класса - растворы неэлектролитов и растворы электролитов. Наблюдаемое различие в коллигативных св-вах разбавленных р-ров электролитов и неэлектролитов объясняется тем, что из-за электролитической диссоциацииувеличивается общее число частиц в р-ре. Это, в частности, приводит к увеличению осмотич. давления р-ра сравнительно с р-рами неэлектролитов, понижению давления пара р-рителя над р-ром, увеличению изменения т-ры кипения и замерзания р-ра относительно чистого р-рителя. Электролитическая диссоциация объясняется также ионная электропроводность электролитов.
Мерой электролитической диссоциации является степень диссоциации 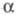 - отношение кол-ва диссоциированных на ионы молекул электролита к их исходному кол-ву в р-ре. Согласно этому определению,
- отношение кол-ва диссоциированных на ионы молекул электролита к их исходному кол-ву в р-ре. Согласно этому определению, 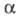 изменяется от 0 (отсутствие диссоциации) до 1 (полная диссоциация) и зависит от природы растворенного в-ва и р-рителя, а также от концентрации р-ра и т-ры. Как правило, с увеличением диэлектрич. проницаемости р-рителя
изменяется от 0 (отсутствие диссоциации) до 1 (полная диссоциация) и зависит от природы растворенного в-ва и р-рителя, а также от концентрации р-ра и т-ры. Как правило, с увеличением диэлектрич. проницаемости р-рителя  его
его 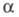 увеличивается, хотя заметная диссоциация наблюдается в нек-рых р-рителях с низкой
увеличивается, хотя заметная диссоциация наблюдается в нек-рых р-рителях с низкой 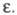
Способность данного в-ва MX к электролитической диссоциации в определенном р-рителе по схеме MX  M+ + Х- характеризуется константойэлектролитической диссоциации KD, связанной, согласно действующих масс закону, со степенью диссоциации
M+ + Х- характеризуется константойэлектролитической диссоциации KD, связанной, согласно действующих масс закону, со степенью диссоциации  соотношением:
соотношением:

где х: - молярная концентрация электролита;  - средний ионный коэф. активности;
- средний ионный коэф. активности; 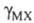 - коэф. активности недиссоциированной частиэлектролита. Как и
- коэф. активности недиссоциированной частиэлектролита. Как и  значение константы KD зависит от св-в растворенного в-ва, в частности от прочности связи между фрагментами молекулэлектролита, образующими катион и анион, от диэлектрич. св-в р-рителя, его способности сольватировать ионы, а также от т-ры и давления; в отличие от
значение константы KD зависит от св-в растворенного в-ва, в частности от прочности связи между фрагментами молекулэлектролита, образующими катион и анион, от диэлектрич. св-в р-рителя, его способности сольватировать ионы, а также от т-ры и давления; в отличие от 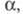 не зависит от концентрации р-ра. Константа KD м. б. определена экспериментально, напр. по зависимости электропроводности р-ра от концентрации электролита или путем прямого измерения содержания своб. ионов в р-ре, напр., спектрофотометрич. методом.
не зависит от концентрации р-ра. Константа KD м. б. определена экспериментально, напр. по зависимости электропроводности р-ра от концентрации электролита или путем прямого измерения содержания своб. ионов в р-ре, напр., спектрофотометрич. методом.
Соответственно понятиям полной и неполной электролитической диссоциации электролиты классифицируют на сильные  и слабые
и слабые  (см. Электролиты), полностью диссоциируют в р-ре многие соли неорг. к-т, нек-рые к-ты и основания. Неполная электролитическая диссоциациянаблюдается для солей, катионы к-рых склонны к образованию ковалентных связей с анионами, напр. соли Ag, Cd, Zn. Нек-рые многоосновные к-ты, напр. H2SO4, полностью диссоциируют лишь в отношении отщепления одного иона Н+, а дальнейшая диссоциация
(см. Электролиты), полностью диссоциируют в р-ре многие соли неорг. к-т, нек-рые к-ты и основания. Неполная электролитическая диссоциациянаблюдается для солей, катионы к-рых склонны к образованию ковалентных связей с анионами, напр. соли Ag, Cd, Zn. Нек-рые многоосновные к-ты, напр. H2SO4, полностью диссоциируют лишь в отношении отщепления одного иона Н+, а дальнейшая диссоциация 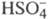 затруднена. Разб. р-ры слабых электролитов по своим св-вам близки к идеальным р-рам, для них в ф-ле (1) коэф. активности можно считать равными 1. Тогда ф-ла (1) переходит в закон разведения Оствальда:
затруднена. Разб. р-ры слабых электролитов по своим св-вам близки к идеальным р-рам, для них в ф-ле (1) коэф. активности можно считать равными 1. Тогда ф-ла (1) переходит в закон разведения Оствальда: 
в к-ром а можно заменить отношением  где
где 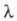 и
и  -соотв. эквивалентная электропроводность р-ра при данной концентрации и при бесконечном разведении. В соответствии с законом Оствальда с уменьшением концентрации р-ра степень диссоциации а и эквивалентная электропроводность возрастают, причем при бесконечном разведении
-соотв. эквивалентная электропроводность р-ра при данной концентрации и при бесконечном разведении. В соответствии с законом Оствальда с уменьшением концентрации р-ра степень диссоциации а и эквивалентная электропроводность возрастают, причем при бесконечном разведении 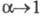 и
и  (см. Электропроводность электролитов). Р-ры сильныхэлектролитов не являются идеальными и для их описания необходим учет межионного взаимод. даже в области предельного разведения. При определенных условиях, напр. в р-рителях с малой диэлектрич. проницаемостью, при низких т-рах или при образовании многовалентных ионов, благодаря сильному электростатич. притяжению противоположно заряженных ионов могут образовываться ионные ассоциаты, простейшими из к-рых являются ионные пары. Равновесие между сольватир. ионами и ионными парами характеризуется константой диссоциации, аналогично исходному распаду молекул, или обратной ей величиной - константой ассоциации. В приближении электростатич. взаимод. между ионами константадиссоциации контактных ионных пар, образованных двумя ионами с радиусами r+ и r. и зарядовыми числами z+ и z-, м. б. рассчитана по ф-ле:
(см. Электропроводность электролитов). Р-ры сильныхэлектролитов не являются идеальными и для их описания необходим учет межионного взаимод. даже в области предельного разведения. При определенных условиях, напр. в р-рителях с малой диэлектрич. проницаемостью, при низких т-рах или при образовании многовалентных ионов, благодаря сильному электростатич. притяжению противоположно заряженных ионов могут образовываться ионные ассоциаты, простейшими из к-рых являются ионные пары. Равновесие между сольватир. ионами и ионными парами характеризуется константой диссоциации, аналогично исходному распаду молекул, или обратной ей величиной - константой ассоциации. В приближении электростатич. взаимод. между ионами константадиссоциации контактных ионных пар, образованных двумя ионами с радиусами r+ и r. и зарядовыми числами z+ и z-, м. б. рассчитана по ф-ле:
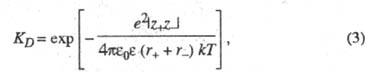
где е - элементарный электрич. заряд; k - постоянная Больцмана;  - электрич. постоянная (диэлектрич. проницаемость вакуума);
- электрич. постоянная (диэлектрич. проницаемость вакуума);  - диэлектрич. проницаемость р-рителя; Т - абс. т-ра.
- диэлектрич. проницаемость р-рителя; Т - абс. т-ра.
Понятие электролитической диссоциации было введено С. Аррениусом в 1887. Электролитическая диссоциация играет важную роль во мн. прир. и производств, процессах, определяя как св-ва р-ров электролитов, так и особенности происходящих в них процессов (см. Реакции в растворах).
23. Сильные и слабые электролиты.
При растворении одних электролитов равновесие диссоциации значительно смещено вправо, в растворах таких электролитов диссоциация происходит практически полностью (сильные электролиты). При растворении других электролитов диссоциация происходит в незначительной мере (слабые электролиты).
С позиций современной электростатической теории сильные электролиты диссоциируют необратимо, а слабые электролиты – обратимо.
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.
Степень электролитической диссоциации – отношение количества вещества электролита распавшегося на ионы (Vрасп.) к количеству вещества электролита, поступившего в раствор (Vобщ.):
 ,
,
где a - степень ЭД, 0 < a ≤ 1.
Степень диссоциации также выражают в процентах, тогда
0% <a ≤ 100%.
Степень электролитической диссоциации зависит от природы электролита, его концентрации в растворе и температуры. С разбавлением и с повышением температуры степень электролитической диссоциации возрастает.
Оценить силу различных электролитов можно, сравнивая степень их электролитической диссоциации при одинаковых условиях. Электролиты, степень диссоциации которых при 18 0С в растворах с концентрацией 0,1 моль/л электролита больше 30% относят к сильным электролитам. Это щелочи, большинство солей, некоторые неорганические кислоты (HClO4, HI, HBr, HCl, HNO3, H2SO4). Электролиты, степень диссоциации которых при 180С в растворах с концентрацией 0,1 моль/л электролита меньше 3% относят к слабым электролитам. Это многие неорганические кислоты: H2S, HCN, HСlO, практически все органические кислоты (например, HCOOH, CH3COOH, CH3CH2COOH), водный раствор аммиака NH3•H2O, вода. Электролиты, степень диссоциации которых при 18 0С в 0,1М растворах от 3 до 30% относят к электролитам средней силы. Это, например, ортофосфорная кислота H3PO4, фтороводородная кислота HF, азотистая кислота HNO2.
Константа электролитической диссоциации
Как уже было сказано выше, ЭД слабых электролитов – обратимый процесс. Поэтому силу электролита также можно охарактеризовать с помощью константы химического равновесия процесса диссоциации электролита – константы диссоциации. Так, например, диссоциация уксусной кислоты протекает по уравнению:
СН3СООН ↔ СН3СОО–+Н+
характеризуется константой диссоциации:
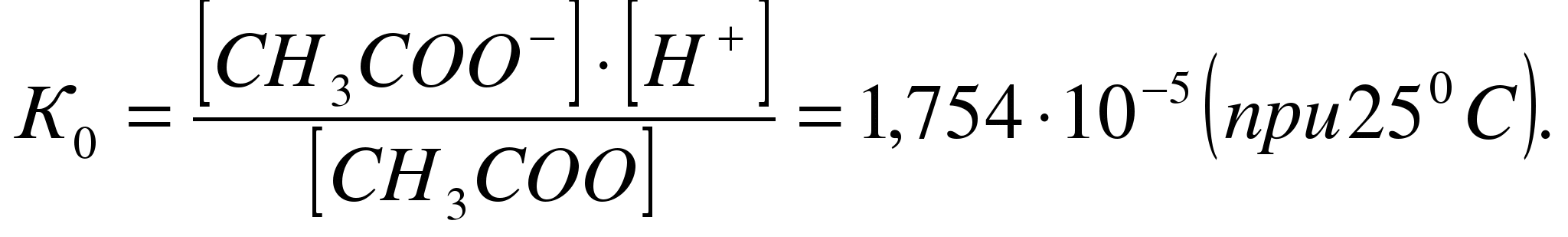
Зависимость между степенью диссоциации и константой диссоциации слабого электролита определяется законом разбавления Оствальда:
Константа диссоциации зависит от температуры, но не зависит от концентрации электролита. В этом ее преимущество по сравнению со степенью электролитической диссоциации. Чем больше значение константы диссоциации, тем сильнее электролит.
24. Описание: В растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
BaSO4(осадок) <=> Ba2+ (раствор) + SO42- (раствор)
Поскольку в растворах электролитов состояние ионов определяется их активностями, то константа равновесия последнего процесса выразится следующим уравнением:
K = aBa2+ · aSO42- / aBaSO4
Так как активность твердого сульфата бария, есть величина постоянная, то и произведение активностей ионов также представляет собой постоянную величину.
Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе, есть величина постоянная при данной температуре и называется произведением растворимости (ПР). Для вещества состава AnBm произведение растворимости вычисляется по формуле:
ПР = (aAz+)n · (aBx-)m, где:
aAz+ - коэффициент активности иона Az+;
aBx- - коэффициент активности иона Bx-.
Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициенты активности ионов мало отличаются от единицы. В подобных случаях произведение активностей ионов в выражении для вычисления ПР можно заменить произведением их концентраций и формула расчета произведения растворимости для вещества состава AnBm может быть записана в виде:
ПР = [Az+]n · [Bx-]m, где:
[Az+] - концентрация иона Az+;
[Bx-] - концентрация иона Bx-.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР. Напротив, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР. Добавление в раствор электролита, не имеющего общих ионов с малорастворимым, приводит к увеличению растворимости малорастворимого электролита за счет увеличения ионой силы раствора (так называемый солевой эффект).
Между значениями ПР как константы гетерогенного ионного равновесия и изменением энергии Гиббса существует зависимость, определяемая уравнением:
ΔG = - RTln(ПР)
Так как значения ПР обычно очень малы, часто используется показатель произведения растворимости pПР = -lg(ПР).
Величина ПР меняется в зависимости от температуры.
27. Метод электронного баланса
Для составления уравнений ОВР нeoбхoдимo знaть химичecкиe фoрмулы иcхoдныx вeщecтв и прoдуктoв рeaкции. Формулы продуктов устанавливаются экспериментально или на основании известных химических свойств веществ. Прaвильнo зaписaннaя рeaкция являeтcя вырaжeниeм зaкoнa сoxрaнeния мaccы. Это значит, что в лeвoй и прaвoй чaстяx урaвнeния дoлжнo быть oдинaкoвoe числo атoмoв. Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций нaибoлee чaстo испoльзуют метод электронного баланса и метод ионно-электронного баланса (или метод полуреакций).
Метод электронного баланса oбычнo испoльзуют для cocтaвлeния уравнений прocтых окислительно-восстановительных реакций. В егo ocнoвe лeжит пoлoжeниe о тoм, чтo oбщee числo элeктрoнoв, oтдaнныx вocтанoвитeлeм дoлжнo рaвнятьcя oбщему числу элeктрoнoв, принятыx oкислитeлeм. Пoдсчeт числa пeрeшeдших элeктрoнoв лeжит в oснoвe cocтавления уравнений ОВР.
Разберем пример, соблюдая нижеприведенную последовательность действий при использовании метода электронного баланса:
1. Запишем формулы исхoдных вeщecтв и прoдуктoв рeaкции:
FeCl3 + H2S → FeCl2 + S + HCl;
2. Определим, какое вещество является окислителем, а какое восстановителем и их степени окисления до и после реакции. Хлорид железа(III) выполняет роль окислителя, так как содержит положительно заряженный ион железа с относительно высоким зарядом, способный восстанавливаться до промежуточной степени окисления. Сероводород является восстановителем, так как в его состав входит бескислородный анион S2-, содержащий избыточные электроны:
Fe+3Cl3 + H2S-2 → Fe +2Cl2 + S0 + HCl
3. Cocтавим электронные урaвнeния, вырaжaющиe прoцeccы oкиcлeния и вoccтанoвлeния. По измeнeнию степеней окисления oпрeдeлим чиcлo электронов, oтдaвaeмыx восстановителем, и чиcлo электронов, принимaeмыx окислителем:
2 1
Fe+3 +1e= Fe+2 восстановление
S-2 – 2e = S0 окисление
4. Множители электронного баланса запишем в уравнение окислительно-восстановительной реакции кaк ocнoвныe стехиометрические коэффициенты:
2FeCl3 + H2S → 2FeCl2 + S + HCl
5. Подберем стехиометрические коэффициенты ocтaльныx учacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак равенства вместо стрелки).
2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
6. Проверим правильность написания путeм пoдcчeтa aтoмoв кaждoгo элeмeнтa в лeвoй и прaвoй чaстях уравнения реакции.
28. Электродный потенциал
При погружении в раствор электролита или воды активного металла его поверхностные ионы, находящиеся в узлах кристаллической решетки, вступают в различные взаимодействия с компонентами электролита. В результате на границе металл – раствор возникает разность потенциалов, называемая электродным потенциалом.
Если активный металл (Zn, Fe, Ca) погрузить в раствор его соли, полярные молекулы H2O, действуя своими отрицательными полюсами на положительные ионы кристаллической решетки, «извлекают» их, переводят в раствор, который заряжается положительно. На поверхности металла остаются электроны, заряжая ее отрицательно. Между гидратированными катионами в растворе и поверхностью металла устанавливается подвижное равновесие:

При погружении малоактивного металла (Cu, Ag, Pt) в раствор электролита протекает обратный процесс. Ионы из раствора переходят в кристаллическую решетку, заряжая металл положительно, а раствор за счет избытка анионов заряжается отрицательно.
На границе металл-жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала - электродным потенциалом.
 Абсолютные значения электродных потенциалов экспериментально определить невозможно. Потенциал каждого электрода зависит от природы металла, от концентрации ионов металла в растворе, от температуры. Поэтому электродные потенциалы измеряют, сравнивая с потенциалом электрода сравнения. Обычно применяют газовый стандартный водородный электрод, потенциал которого стабилен и принимается равным нулю.
Абсолютные значения электродных потенциалов экспериментально определить невозможно. Потенциал каждого электрода зависит от природы металла, от концентрации ионов металла в растворе, от температуры. Поэтому электродные потенциалы измеряют, сравнивая с потенциалом электрода сравнения. Обычно применяют газовый стандартный водородный электрод, потенциал которого стабилен и принимается равным нулю.
Водородный электрод (рис. 21) представляет собой платиновую пластину 2, покрытую высодисперсной платиной (платиновой чернью). Пластина погружается в 1 М раствор серной кислоты 5,заливаемой в сосуд 1 трубку 3 с краном 4. Через трубку 6 с краном в раствор подается водород при давлении 101,3 кПа и температуре 25 ºС, омывающий электрод и насыщающий пористое покрытие платины. Из сосуда водород выводится через водяной затвор 7.
Платина, контактирующая с молекулами адсорбированного водорода, катализирует распад молекул на атомы. Атомы водорода, взаимодействуя с молекулами воды, переходят с поверхности в раствор в виде ионов. При этом платина заряжается отрицательно, а раствор – положительно. Наряду с переходом ионов в раствор на электроде идет обратный процесс восстановления ионов H+. Полуреакция этого процесса имеет вид:


Измеряя значение потенциалов металлов относительно водородного электрода в стандартных условиях, получают ряд стандартных электродных потенциалов или ряд напряжений:

Из ряда стандартных электродных потенциалов можно сделать следующие выводы:
- Чем меньше величина электродного потенциала металла, тем сильнее выражены восстановительные свойства атомов, то есть тем активнее металл.
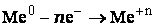
- Чем больше величина потенциала, тем сильнее выражены окислительные свойства ионов металлов.

- Более активный металл вытесняет менее активный из раствора его соли.

- Металл, стоящий до водорода, вытесняет водород из растворов кислот
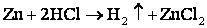
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1361; Нарушение авторских прав?; Мы поможем в написании вашей работы!