
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Нернста
|
|
|
|
Электродные потенциалы зависят от природы веществ, участвующих в электродном процессе, от соотношения между активностями этих веществ и температуры. Для разбавленных растворов, эта зависимость выражается уравнением Нернста в следующей форме:
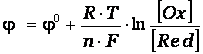
где 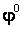 - стандартный электродный потенциал данного процесса, = 8,31 Дж/(мольК) - универсальная газовая постоянная,
- стандартный электродный потенциал данного процесса, = 8,31 Дж/(мольК) - универсальная газовая постоянная, 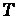 - абсолютная температура раствора,
- абсолютная температура раствора, 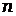 - число молей электронов передаваемых в процессе,
- число молей электронов передаваемых в процессе, 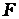 = 96500 Кл/моль - постоянная Фарадея, [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и восстановленной(Red) формах. В общем случае в уравнении Нернста вместо концентраций необходимо использовать активности веществ.
= 96500 Кл/моль - постоянная Фарадея, [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и восстановленной(Red) формах. В общем случае в уравнении Нернста вместо концентраций необходимо использовать активности веществ.
После подстановки значений постоянных величин для стандартной при электрохимических измерениях температуре Т = 298 К уравнение Нернста имеет вид:
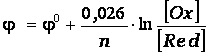 .
.
В электрохимической реакции растворения металла в растворе собственных ионов в условиях равновесия скорость растворения равна скорости разряда его ионов. Потенциал, устанавливающийся на электроде при равновесии, называется равновесным потенциалом металла.
При постоянных давлении и температуре для чистого металла активность и концентрацию металла можно положить равной, то есть
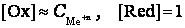 .
.
Тогда
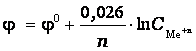
29. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ, единичные ячейки хим. источников тока, предназначенных для однократного электрич. разряда (непрерывного или прерывистого). После разряда гальванические элементы, в отличие от аккумуляторов, теряют работоспособность. Иногда термин "гальванические элементы" применяют и для обозначения единичных ячеек аккумуляторных батарей, к-рые предназначены для многократного использования, т. е. после разряда м. б. снова заряжены. Главные составные части гальванических элементов: два электрода разл. природы и электролит. Обычноэлектроды - это металлич. пластинки или сетки, на к-рые нанесены реагенты ("активные в-ва"); на отрицат. электрод - восстановитель (Zn, Li и др.), на положительный -окислитель (оксиды Mn, Hg и др., а также соли). На каждом из электродов, погруженных в электролит, устанавливается определенный потенциал (окислит.-восстановит. потенциал данной электродной р-ции); разность этих потенциалов в отсутствие тока наз. напряжением разомкнутой цепи (НРЦ). При соединении электродов между собой с помощью внеш. электрич. цепи электроны начинают перетекать от отрицат. электрода к положительному - возникает электрич. ток. Суммарная электрохим. р-ция на обоих электродах наз. токообразующей; по мере ее протекания восстановитель отдает, а окислитель присоединяет электроны. Ток прекращается при размыкании внеш. цепи, а также после израсходования запаса хотя бы одного из реагентов. Побочные хим. или электрохим. р-ции приводят к саморазряду гальванических элементов, ограничивающему длительность их хранения, к-рая для лучших образцов может достигать 10 лет. Гальванические элементы применяют гл. обр. для питания переносной аппаратуры (напр., транзисторных радиоприемников) и поэтому изготавливают преим. с невыливающимся электролитом(загущенным или твердым). В отличие от аккумуляторов, гальванические элементы не нуждаются в особом уходе при эксплуатации.
Наиб. распространены марганцево-цинковые элементы (окислитель-МnО2, восстановитель-Zn) с солевым электролитом (р-р NH4C1 и др.) или щелочным (р-р КОН). Для них НРЦ 1,5-1,8 В, уд. энергия 10-80 Вт-ч/кг. Стоимость элементов сравнительно невелика, и их мировое произ-во достигает 8-10 млрд. штук в год. Элементы со щелочным электролитом дороже, но обладают лучшими характеристиками, особенно при низких т-рах и повыш. токах разряда.
Для ртутно-цинковых элементов (окислитель-HgO) со щелочным электролитом НРЦ 1,35 В, уд. энергия до 400 Вт • ч/л. Их изготавливают в виде малогабаритных ("пуговичных") герметичных устройств и применяют для питания радиоприемников, кино- и фотоаппаратуры и т.п.
В воздушно-цинковых элементах окислителем вместо относительно дорогих оксидов металлов служит О2 воздуха, к-рый участвует в р-ции наэлектроде, изготовленном из каталитически активного угля. Спец. отверстие в крышке обеспечивает своб. доступ воздуха к электроду. Отсутствие заложенного запаса окислителя обеспечивает высокие значения уд. энергии - до 250 Вт*ч/кг. Недостатки этих элементов - небольшое значение разрядного тока и сравнительно быстрый саморазряд, что обусловлено взаимод. щелочного электролита с окружающей атмосферой. В результатеэлектролит высыхает либо взаимод. с СО2 воздуха (карбонизируется). Поэтому такие элементы пока не получили широкого распространения.
В гальванических элементах с неводными электролитами возможно применение очень активных восстановителей (напр., щелочных металлов) иокислителей, к-рые в водных р-рах неустойчивы. При использовании расплавленных или твердых электролитов такие гальванические элементы могут работать при повыш. т-pax. В литиевых элементах на основе апротонных р-рителей восстановителем служит тонкий лист Li, напрессованный напластину или сетку из Ni или Си. Окислители - гл. обр. твердые МпО2 или фторированный графит. Разработаны элементы с р-рителями, выполняющими одновременно роль окислителя, - жидким SOC12 или сжиженным SO2. To-кообразующие р-ции приводят к непосредственномувосстановлению молекул р-рителя под действием Li; детальный механизм разряда окончательно не установлен. Благодаря высокому отрицат. потенциалу Li и его малому расходу литиевые элементы имеют высокие НРЦ (2,5-3,5 В) и уд. энергию (250-600 Вт*ч/кг). Литиевые элементы применяют преим. для питания кардиостимулято-ров, микрокалькуляторов и др. миниустройств.
Разновидность гальванических элементов - резервные элементы, в к-рых с целью снижения саморазряда электролит разобщен с электродами или находится в твердом неионопроводящем состоянии. Непосредственно перед использованием таких гальванических элементов электроды приводят в контакт с электролитом или расплавляют электролит. Напр., при изготовлении т. наз. водоактивируемых гальванических элементов безводнующелочь или соль закладывают в мешочках в межэлектродное пространство; перед эксплуатацией в отверстие в крышке заливают воду, и образуетсяэлектролит требуемой концентрации.
30. Аккумуляторы.
Явление поляризации, вредное в гальванических элементах, находит, однако, и полезное применение. В 1895 г. Планте показал, что э. д. с. поляризации можно, использовать для практического получения электрического тока. Он построил элемент с двумя свинцовыми электродами, погруженными в раствор серной кислоты. Элемент в таком виде не обладает еще э. д. с., так как оба его электрода одинаковы. Если, однако, через такой элемент пропускать известное время ток, то на его электродах выделяются продукты электролиза, которые вступают в химическую реакцию с электродами. Благодаря этому электроды оказываются различными по химическому составу, и появляется определенная э. д. с. – именно, э. д. с. поляризации, равная приблизительно 2 В. Элемент в таком состоянии является уже сам источником тока и при замыкании на какую-либо цепь может создавать в ней в течение некоторого времени электрический ток. Таким образом, для появления э. д. с. в элементе Планте через него необходимо пропускать в течение известного времени ток от постороннего источника. Этот процесс называется зарядкой элемента.
Элемент Планте и ему подобные, использующие явление поляризации, называются вторичными элементами или аккумуляторами, так как в них можно запасать (аккумулировать) энергию. После израсходования энергии аккумулятора его можно вновь зарядить пропусканием тока и повторять этот процесс много раз.
С энергетической точки зрения дело обстоит так. Реакции, протекающие в аккумуляторе при его зарядке и делающие первоначально одинаковые электроды химически различными, являются реакциями, которые могут осуществляться лишь при притоке энергии извне. Эту энергию доставляет генератор, при помощи которого мы заставляем ионы перемещаться в растворе и выделяться на соответствующих электродах. Напротив, при разрядке аккумулятора в нем происходят реакции, идущие с выделением энергии. Эти реакции и являются источником э. д. с. аккумулятора. Таким образом, при зарядке аккумулятора происходит превращение электрической энергии в скрытую химическую энергию, а при его разрядке – обратный переход химической энергии в энергию электрического тока.
Устройство современного свинцового аккумулятора показано на рис. 124. Он состоит из ряда положительных и отрицательных пластин, находящихся в банке с водным раствором (15-20%) серной кислоты. Все положительные пластины соединены между собой, так же как и все отрицательные, благодаря чему в небольшом сосуде можно иметь большую площадь электродов, разделенных тонким слоем электролита, т. е. иметь элемент с чрезвычайно малым внутренним сопротивлением.
Отрицательные пластины состоят из чистого металлического свинца, поверхность которого сделана мелкопористой для увеличения действующей площади электродов (губчатый свинец). Положительные пластины имеют более сложное строение, показанное на рис. 125. При их изготовлении сначала отливают (или штампуют) раму из свинца, снабженную многими ячейками наподобие пчелиных сотов, и в них впрессовывают специальную массу, состоящую из окислов свинца и связующих веществ.
В незаряженном состоянии оба электрода покрыты слоем сернокислого свинца (). При зарядке ионы перемещаются к одному электроду и превращают его в перекись свинца по уравнению,а ионы H+ восстанавливают второй электрод в металлический свинец по уравнению
Соединение становится анодом, a Pb – катодом заряженного аккумулятора. При разрядке ток по внешней цепи идет от к Pb, а внутри аккумулятора ионы и движутся в направлениях, обратных их движению при зарядке, и реакции на электродах протекают в обратном направлении. Во вполне разряженном аккумуляторе оба электрода опять состояли бы из. В рабочих условиях не доводят аккумулятор до полной разрядки и вновь заряжают его, когда напряжение на электродах падает примерно до 1,8 В. Свежезаряженный свинцовый аккумулятор имеет напряжение около 2,7 В. Но при разрядке это напряжение быстро падает до 2 В и затем долго остается постоянным. После длительной разрядки напряжение аккумулятора вновь начинает падать; разрядку его следует прекратить, когда напряжение упадет до 1,85 В.
Помимо свинцовых аккумуляторов существуют и другие. В настоящее время широко употребляются железоникелевые аккумуляторы («щелочные» аккумуляторы). У них электродами являются железо и никель, а электролитом – 20%-ный раствор едкой щелочи (КОН или NaOH). В заряженном состоянии никелевые пластины покрыты слоем окиси никеля () и служат положительным полюсом, а металлическое железо – отрицательным; э. д. с. этих аккумуляторов равна 1,4-1,1 В. Железоникелевые аккумуляторы характеризуются большой устойчивостью: механические сотрясения и небрежность в уходе, могущая вызывать вредные химические реакции, для этих элементов гораздо менее опасны, чем для свинцовых.
Различные аккумуляторы характеризуются максимальным количеством электричества, которое можно получить от них без новой зарядки. Это количество электричества принято выражать в ампер-часах (А×ч) и называть емкостью аккумулятора. Так, например, переносные аккумуляторы, применяющиеся для автомобилей, имеют обычно емкость 40 А×ч. Это значит, что они могут давать ток 1 А в течение 40 ч или ток 2 А в течение 20 ч и т. д. При этом, конечно, разрядный ток не должен превышать некоторой максимальной силы (для свинцового аккумулятора приблизительно 1 А на каждый квадратный дециметр поверхности положительных пластин), так как в противном случае пластины быстро разрушаются. Чем больше площадь пластин аккумулятора, тем больше продуктов электролиза может быть удержано на пластинах, а значит, и тем больший заряд можно получить от аккумулятора при разрядке, т. е. тем больше его емкость.
79.1. Батарея аккумуляторов емкости 20 А×ч питает лампочку, потребляющую ток 0,25 А. Сколько времени может гореть лампочка без новой зарядки аккумуляторов?Аккумуляторы играют в современной электротехнике важную роль. Так, например, на электрических станциях с неравномерной нагрузкой часто устанавливают, кроме генераторов постоянного тока, еще и батареи аккумуляторов (буферные аккумуляторы). При малой нагрузке станции часть энергии, вырабатываемой генераторами, расходуется на зарядку аккумуляторов, а в периоды большой нагрузки эти аккумуляторы питают сеть параллельно с генераторами. Электростанции, использующие энергию ветра, всегда бывают снабжены аккумуляторами, которые заряжаются в те периоды, когда имеется ветер, а затем уже расходуют запасенную энергию по мере надобности и независимо от метеорологических условий.
Аккумуляторы широко применяют на всех подводных судах (кроме подводных судов с атомным двигателем). При надводном плавании аккумуляторы заряжаются от генератора постоянного тока, а при погружении под воду все механизмы приводятся в движение исключительно от аккумуляторов. Аккумуляторы с успехом применяются в электрических грузовых тележках, так называемых электрокарах, которые должны работать короткие промежутки времени и делать частые остановки и на которых поэтому невыгодна установка двигателей внутреннего сгорания, непрерывно поглощающих топливо; в автомобилях (зажигание в моторах, освещение); для питания рудничных ламп и еще во многих важных промышленных машинах и приборах. Очень широко распространены аккумуляторы в лабораторной практике, где они являются хорошими источниками постоянного тока, а также в радиотехнике.
Несмотря на большие преимущества аккумуляторов, которые во многих случаях вытеснили гальванические элементы, последние все еще имеют ряд важных применений: в качестве эталонов напряжения (нормальные элементы, § 75), для питания радиоприемников, карманных фонарей, микрокалькуляторов и т. п.
31. Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электролиз является одним из важнейших направлений в электрохимии.Законы электролиза Фарадея. С количественной стороны процесс электролиза впервые был изучен в 30-х годах XIX века выдающимся английским физиком Фарадеем, который в результате своих исследований установил следующие законы электролиза:
1. Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества.
Этот закон вытекает из сущности электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс — взаимодействие ионов или молекул электролита с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Ясно, что количество вещества, получающегося у электрода.всегда будет пропорционально числу прошедших по цепи электронов, т.е. количеству электричества.
2. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств вещества.
Пусть, например, электрический ток последовательно проходит через растворы соляной кислоты, нитрата серебра, хлорида меди (II) и хлорида олова (IV). Через некоторое время определяют
количества выделившихся продуктов электролиза. Оказывается, что за время, в течение которого из раствора соляной кислоты выделяется 1 г водорода, т.е. 1 моль атомов, из остальных растворов выделяются указанные ниже массы металлов:
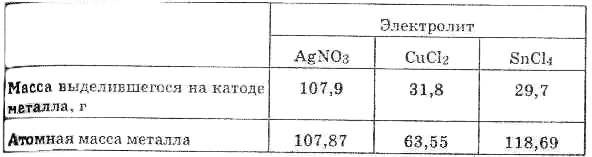
Сопоставляя выделившиеся массы с атомными массами тех же металлов, находим, что выделяется 1 моль атомов серебра, 1/2 моля атомов меди и 1/4 моля атомов олова. Другими словами, количества образовавшихся на катоде веществ равны их эквивалентам. К такому же выводу приводит и измерение количеств веществ, выделяющихся на аноде. Так, в первом, третьем и четвертом приборах выделяется по 35,5 г хлора, а во втором — 8 г кислорода; нетрудно видеть, что и здесь вещества образуются в количествах, равных их эквивалентам.
Рассматривая второй закон электролиза с точки зрения электронной теории, нетрудно понять, почему при электролизе вещества выделяются в химически эквивалентных количествах. Обратимся, например, к электролизу хлорида меди (II). При выделении меди из раствора каждый ион меди получает от катода два электрона, и в то же время два хлорид-иона отдают электроны аноду, превращаясь в атомы хлора. Следовательно, число выделившихся атомов меди всегда будет вдвое меньше числа выделившихся атомов хлора, т.е. массы меди и хлора будут относиться друг к другу как их эквивалентные массы.
Измерениями установлено, что количество электричества, обуславливающее электрохимическое превращение одного эквивалента вещества, равно 96485 (округленно 96500) кулонам. Это количество электричества называется Фарадеем и обозначается буквой F. Второй закон электролиза дает прямой метод определения «эквивалентов различных элементов. На этом же законе основаны расчеты, связанные с электрохимическими производствами. Зависимость количества вещества, образовавшегося под действием электрического тока, От времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:
m=(Э/F)•I•t=(M/n•F)•I•t,,где m — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль);М — молярная масса вещества (г/моль); n — количество отдаваемых или принимаемых электронов; I — сила тока (A); t — продолжительность процесса (с); F — константа Фарадея, характеризующая количества электричества, необходимое для выделения 1 эквивалентной массы вещества (F=96500 Кл/моль=26,8 А•ч/моль).
32. В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и способностью образовывать положительно заряженные ионы. Следовательно, металлы в свободном состоянии являются восстановителями.
Восстановительная способность различных металлов неодинакова и определяется положением в электрохимическом ряду напряжения металлов:
Li K Rb Cs Ca Na Mg Al Mn Zn Cr Cr Fe Ni Sn Pb Cu Hg Ag Pt Ag Pt Au
Металлы размещены в порядке убывания их восстановительных свойств и усиления окислительных свойств их ионов. Этот ряд характеризует химическую активность металлов только в окислительно-восстановительных реакциях, протекающих в водной среде.
Характерными свойствами для металлов являются следующие:
Восстановление неметаллов Реакции с галогенами и кислородом воздуха протекают с различными скоростями и при различных температурах с разными металлами. Так, щелочные металлы легко окисляются кислородом воздуха и взаимодействуют с простыми веществами, железо и медь взаимодействуют с простыми веществами только при нагревании, золото и платиновые металлы не окисляются вообще. Многие металлы образуют на поверхности оксидную пленку, которая защищает их от дальнейшего окисления.
2Мg + О2 = 2МgО
33. Способы получения металлов.
Огромное большинство металлов находится в природе в виде соединений с другими элементами.
Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, серебро и медь - отчасти в самородном виде; иногда попадаются также самородные ртуть, олово и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой воды, или путем извлечения их из породы различными реагентами с последующим выделением металла из раствора. Все остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главными рудами являются оксиды, сульфиды и карбонаты металлов.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем.
Если, например, смешать красную медную руду (куприт) Cu 2 O с углем и подвергнуть сильному накаливанию, то уголь, восстанавливая медь, превратится в оксид углерода(II), а медь выделится в расплавленном состоянии:
Cu 2 O + C = 2Cu + CO
Подобным же образом производится выплавка чугуна их железных руд, получение олова из оловянного камня SnO 2 и восстановление других металлов из оксидов.
При переработке сернистых руд сначала переводят сернистые соединения в кислородные путем обжигания в особых печах, а затем уже восстанавливают полученные оксиды углем. Например:
2ZnS + 3O 2 = 2ZnO + 2SO 2
ZnO + C = Zn + CO
В тех случаях, когда руда представляет собой соль угольной кислоты, ее можно непосредственно восстанавливать углем, как и оксиды, так как при нагревании карбонаты распадаются на оксид металла и двуокись углерода. Например:
ZnCO 3 = ZnO + CO 2
Обычно руды, кроме химического соединения данного металла, содержат еще много примесей в виде песка, глины, известняка, которые очень трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают различные вещества, образующие с примесями легкоплавкие соединения - шлаки. Такие вещества называются флюсами. Если примесь состоит из известняка, то в качестве флюса употребляют песок, образующий с известняком силикат кальция. Наоборот, в случае большого количества песка флюсом служит известняк.
Во многих рудах количество примесей (пустой породы) так велико, что непосредственная выплавка металлов из этих руд является экономически невыгодной. Такие руды предварительно “обогащают”, то есть удаляют из них часть примесей. Особенно широким распространением пользуется флотационный способ обогащения руд (флотация), основанный на различной смачиваемости чистой руды и пустой породы.
Техника флотационного способа очень проста и в основном сводится к следующему. Руду, состоящую, например, из сернистого металла и силикатной пустой породы, тонко измельчают и заливают в больших чанах водой. К воде прибавляют какое-нибудь малополярное органическое вещество, способствующее образованию устойчивой пены при взбалтывании воды, и небольшое количество специального реагента, так называемого “коллектора”, который хорошо адсорбируется поверхностью флотируемого минерала и делает ее неспособной смачиваться водой. После этого через смесь снизу пропускают сильную струю воздуха, перемешивающую руду с водой и прибавленными веществами, причем пузырьки воздуха окружаются тонкими масляными пленками и образуют пену. В процессе перемешивания частицы флотируемого минерала покрываются слоем адсорбированных молекул коллектора, прилипают к пузырькам продуваемого воздуха, поднимаются вместе с ними кверху и остаются в пене; частицы же пустой породы, смачивающиеся водой, оседают на дно. Пену собирают и отжимают, получая руду с значительно большим содержанием металла.
Для восстановления некоторых металлов из их оксидов применяют вместо угля водород, кремний, алюминий, магний и другие элементы.
Процесс восстановления металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии.
Очень важным способом получения металлов является также электролиз. Некоторые наиболее активные металлы получаются исключительно путем электролиза, так как все другие средства оказываются недостаточно энергичными для восстановления их ионов.
34. Коррозия – самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий). Это слово произошло от латинского corrodere – разъедать. Среда, в которой металл подвергается коррозии (корродирует), называется коррозионной или агрессивной. 1) атмосферная – характеризует процесс в условиях влажной воздушной среды. Это наиболее распространенный вид коррозии, так как большинство конструкций эксплуатируют в атмосферных условиях. Ее можно разделить следующим образом: на открытом воздухе, с возможностью попадания на поверхность машин осадков, или с защитой от них в условиях ограниченного доступа воздуха и в замкнутом воздушном пространстве;
2) подземная – разрушение металла в почвах и грунтах. Разновидность этой коррозии – электрохимическая коррозия под воздействием блуждающих токов. Последние возникают в грунте вблизи источников электрического тока (систем передачи электроэнергии, электрифицированных транспортных путей);
3) жидкостная коррозия, или коррозия в электролитах. Ее частным случаем является подводная коррозия – разрушение металлических конструкций, погруженных в воду. По условиям эксплуатации металлоконструкций, этот вид подразделяют на коррозию при полном и неполном погружении; при неполном погружении рассмотрен процесс коррозии по ватерлинии. Водные среды могут отличаться коррозийной активностью в зависимости от природы растворенных в них веществ (морская, речная вода, кислотные и щелочные растворы химической промышленности и т. п.). При подводной коррозии возможны процессы коррозии оборудования в неводных жидких средах, которые подразделяют на неэлектропроводящие и электропроводящие. Такие среды специфичны для химической, нефтехимической и других отраслей промышленности. К химической коррозии относят процесс, в котором окисление металла и восстановление среды представляют единый акт (отсутствие проводников второго рода). Химическая коррозия – это разрушение металлов в окислительных средах при высоких температурах. Различают два вида: газовая (т. е. окисление металла при нагреве) и коррозия в неэлектролитах:
а) характерной особенностью газовой коррозии является отсутствие влаги на поверхности металла. На скорость газовой коррозии влияет, прежде всего температура и состав газовой среды. В промышленности часто встречаются случаи этой коррозии: от разрушения деталей нагревательных печей до коррозии металла при термической обработке.
б) коррозия металлов в неэлектролитах, независимо от их природы, сводится к химической реакции между металлом и веществом. В качестве неэлектролитов используют органические жидкости.
35. Методы защиты от коррозии. Для ослабления коррозионного процесса требуется повлиять либо на сам металл, либо на коррозионную среду. Выделяют основные направления для борьбы с коррозией:
1) легирование металла, либо замена его другим, более коррозионностойким;
2) защитные покрытия (металлические и неметаллические) органического или неорганического происхождения;
3) электрохимическая защита, различают катодную, анодную и протекторную как вариант катодной защиты.
Например, при атмосферной коррозии применяют покрытия органического и неорганического происхождения; от подземной коррозии эффективна электрохимическая защита;
4) введение ингибиторов (веществ, замедляющих скорость реакции.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2324; Нарушение авторских прав?; Мы поможем в написании вашей работы!