
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение атомных масс. Валентность
|
|
|
|
Закон Авогадро позволяет определить число атомов, входящих в состав молекул простых газов. Путем изучения объемных отношений при реакциях, в которых участвуют водород, кислород, азот и хлор, было установлено, что молекулы этих газов двухатомны. Следовательно, определив относительную молекулярную массу любого из этих газов и разделив ее пополам, можно было сразу найти относительную атомную массу соответствующего элемента. Например, установили, что молекулярная масса хлора равна 70,90; отсюда атомная масса хлора равняется 35,45.
Другой метод определения атомных масс, получивший более широкое применение, был предложен в 1858 г. итальянским ученым С. Канниццаро. По этому методу сначала определяют молекулярную массу возможно большего числа газообразных или легколетучих соединений данного элемента. Затем, на основания данных анализа, вычисляют, сколько атомных единиц массы приходится на долю этого элемента в молекуле каждого из взятых соединений. Наименьшее из полученных чисел и принимается за искомую массу.
Метод Канниццаро позволял находить атомные массы только тех элементов, которые входят в состав газообразных или легко переходящих в газообразное состояние соединений. Большинство же металлов не образует таких соединений. Поэтому при определении атомных масс металлов в свое время был использован другой метод, основанный на зависимости между атомной массой элемента и удельной теплоемкостью соответствующего простого вещества в твердом состоянии.
В 1819 г. французские ученые П. Л. Дюлонг и А. Пти, определяя теплоемкость различных металлов, нашли, что произведение.удельной теплоемкости простого вещества (в твердом состоянии) на молярную массу атомов соответствующего элемента для большинства элементов приблизительно одинаково. Среднее значение этой величины равно 26. Поскольку это произведение представляет собой количество теплоты, необходимое для нагревания 1 моля атомов элемента на 1 градус, то оно называется атомной теплоемкостью. Найденная закономерность получила название правила Дюлонга и Пти:
|
|
|
Атомная теплоемкость большинства простых веществ в твердом состоянии лежит в пределах 22-29.
Из правила Дюлонга и Пти следует, что разделив 26 на удельную теплоемкость простого вещества, легко определяемую из опыта, можно найти приближенное значение молярной массы атомов соответствующего элемента, а значит, и приближенное значение атомной массы элемента.
Рассмотренные нами методы определения атомных масс не дают вполне точных результатов, так как, с одной стороны, точность определения молекулярной массы по плотности пара редко превышает 1%, а с другой, — правило Дюлонга и Пти позволяет найти лишь приближенное значение атомной массы. Однако, исходи из получаемых этими методами приближенных величин, легко находить точные значения атомных масс. Для этого надо сравнить найденное приближенное значение молярной массы атомов элемента с его эквивалентной массой. Такое сравнение оказывается полезным, поскольку между молярной массой атомов элемента и его эквивалентной массой существует соотношение, в которое входит также валентность элемента. Рассмотрим последнее понятие несколько подробнее.
Валентность. Понятие о валентности было введено в химию в середине XIX века. Связь между валентностью элемента и его положением в периодической системе была установлена Менделеевым. Он же ввел понятие о переменной валентности. С развитием теории строения атомов и молекул понятие валентности получило физическое обоснование.
Валентность — сложное понятие. Поэтому существует несколько определений валентности, выражающих различные стороны этого понятия. Наиболее общим можно считать следующее определение: валентность элемента — это способность его атомов соединяться с другими атомами в определенных соотношениях.
|
|
|
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того пли иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду.
У большинства элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум, а по кислороду шести. Кроме того, большинство элементов проявляют в разных своих соединениях различную валентность. Например, углерод образует с кислородом два оксида: монооксид углерода СО и диоксид углерода.
В монооксиде углерода валентность углерода равна двум, а в диоксиде — четырем. Из рассмотренных примеров следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Кроме валентности по водороду и по кислороду, способность атомов данного элемента соединяться друг с другом или с атомами других элементов можно выразить иными способами: например, числом химических связей, образуемых атомом данного элемента, или числом атомов, непосредственно окружающих данный атом. С этими и близкими к ним понятиями будем знакомиться после изучения теории строения атома.
Между валентностью элемента в данном соединении, молярной массой его атомов и его эквивалентной массой существует простое соотношение, непосредственно вытекающее из атомной теории и определения понятия «эквивалентная масса». Пусть, например, валентность элемента по водороду равна единице. Это значит, что один моль атомов данного элемента может присоединить или заместить один моль атомов водорода, т. е. один эквивалент водорода. Следовательно, эквивалентная масса этого элемента равна молярной массе его атомов. Но если валентность элемента равна двум, то молярная масса его атомов и его эквивалентная масса уже не будут совпадать друг с другом: эквивалентная масса будет в 2 раза меньше молярной массы. Например, эквивалентная масса кислорода (8 г/моль) равна половине молярной массы его атомов (16 г/моль), так как один моль атомов кислорода соединяется с двумя молями атомов водорода, т. е. с двумя эквивалентами водорода, так что на 1,0079 водорода приходится 8 г кислорода. Эквивалентная масса алюминия, валентность которого равна трем, в 3 раза меньше молярной массы его атомов и т. д.
|
|
|
Таким образом, эквивалентная масса элемента равна молярной массе его атомов, деленной на валентность элемента в данном соединении. Это соотношение можно записать так:

или
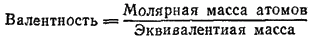
Валентность, определяемая последним соотношением, называется стехиометрической валентностью элемента. Пользуясь этим соотношением, нетрудно установить точное значение атомной массы элемента, если известны ее приближенное значение и точное значение эквивалентной массы. Для этого сначала находят стехиометрическую валентность элемента делением приближенного значения молярной массы атомов элемента на эквивалентную массу.
Поскольку стехиометрическая валентность всегда выражается целым числом, то полученное частное округляют до ближайшего целого числа. Умножая затем эквивалентную массу на валентность, получают точную величину молярной массы атомов элемента, численно совпадающую с атомной массой элемента.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 879; Нарушение авторских прав?; Мы поможем в написании вашей работы!