
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ядерная модель атома
|
|
|
|
Изучение радиоактивности подтвердило сложность состава атомов. Встал вопрос о строении атома, о его внутренней структуре.
Согласно модели, предложенной в 1903 г. Дж. Дж. Томсоном, атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов, колеблющихся внутри этого заряда. Для проверки гипотезы Томсона и более точного определения внутреннего строения атома Э. Резерфорд провел серию опытов по рассеянию альфа-частиц тонкими металлическими пластинками. Источник альфа-излучения И помещали в свинцовый кубик К с просверленным в нем каналом, так что удавалось получить поток альфа-частиц, летящих в определенном направлении. Попадая на экран Э, покрытый сульфидом цинка, альфа-частицы вызывали его свечение, причем в лупу Л можно было увидеть и подсчитать отдельные вспышки, возникающие на экране при попадании на него каждой частицы.
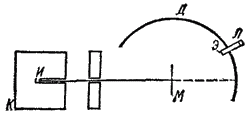
Рис.2. Схема опыта по рассеянию частиц.
Между источником излучения и экраном помещали тонкую металлическую фольгу М. По вспышкам на экране можно было судить о рассеянии альфа-частиц, т. е. об их отклонении от первоначального направления при прохождении через слой металла.
Оказалось, что большинство альфа-частиц проходит через фольгу, не изменяя своего направления, хотя толщина металлического листочка соответствовала сотням тысяч атомных диаметров. Но некоторая доля альфа-частиц все же отклонялась на небольшие углы, а изредка альфа-частицы резко изменяли направление своего движения и даже отбрасывались назад, как бы натолкнувшись на массивное препятствие. Случаи такого резкого отклонения альфа-частиц можно было наблюдать, перемещая экран с лупой по дуге Д.
Из результатов этих опытов следовало, что подавляющая часть пространства, занимаемого атомом металла, не содержит тяжелых частиц — там могут находиться только электроны. Ведь масса электрона почти в 7500 раз меньше массы альфа-частицы, так что столкновение с электроном практически не может повлиять на направление движения альфа-частицы. Случаи же резкого отклонения и даже отбрасывания альфа-частиц означают, что в атоме есть какое-то тяжелое ядро, в котором сосредоточена преобладающая часть всей массы атома. Это ядро занимает очень маленький объем — именно поэтому альфа-частицы так редко с ним сталкиваются — и должно обладать положительным зарядом, который и вызывает отталкивание одноименно заряженных альфа-частиц.
Исходя из этих соображений, Резерфорд в 1911 г. предложил следующую схему строения атома, получившую название ядерной модели атома. Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален. Возникающая вследствие вращения электронов центробежная сила уравновешивается силой электростатического притяжения электронов к противоположно заряженному ядру. Размеры ядра очень малы по сравнению с размерами атома в целом.
Чем больше заряд атомного ядра, тем сильнее будет отталкиваться от него альфа-частица, тем чаще будут встречаться случаи сильных отклонений альфа-частиц, проходящих через слой металла, от первоначального направления движения.
Поэтому опыты по рассеянию альфа-частиц дают возможность не только обнаружить существование атомного ядра, но и определить его заряд. Уже из опытов Резерфорда следовало, что заряд ядра (выраженный в единицах заряда электрона) численно равен порядковому номеру элемента в периодической системе. Это было подтверждено Г. Мозли, установившим в 1913 г. простую связь между длинами волн определенных линий рентгеновского спектра элемента и его порядковым номером, и Д. Чедвиком, с большой точностью определившим в 1920 г. заряды атомных ядер ряда элементов по рассеянию альфа-частиц.
Был установлен физический смысл порядкового номера элемента в периодической системе: порядковый номер оказался важнейшей константой элемента, выражающей положительный заряд ядра его атома. Из электронейтральности атома следует, что и число вращающихся вокруг ядра электронов равно порядковому номеру элемента.
Это открытие дало новое обоснование расположению элементов в периодической системе. Вместе с тем оно устраняло и кажущееся противоречие в системе Менделеева — положение некоторых элементов с большей атомной массой впереди элементов с меньшей атомной массой (теллур и иод, аргон и калий, кобальт и никель). Оказалось, что противоречия здесь нет, так как место элемента в системе определяется зарядом атомного ядра. Было экспериментально установлено, что заряд ядра атома теллура равен 52, а атома иода — 53; поэтому теллур, несмотря на большую атомную массу, должен стоять до иода. Точно так же заряды ядер аргона и калия, никеля и кобальта полностью отвечают последовательности расположения этих элементов в системе.
Итак, заряд атомного ядра является той основной величиной, от которой зависят свойства элемента и его положение в периодической системе. Поэтому периодический закон Менделеева в настоящее время можно сформулировать следующим образом:
Свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов.
Определение порядковых номеров элементов по зарядам ядер их атомов позволило установить общее число мест в периодической системе между водородом, имеющим порядковый номер 1, и ураном (порядковый номер 92), считавшимся в то время последним членом периодической системы элементов. Когда создавалась теория строения атома, оставались незанятыми места 43, 61, 72, 75, 85 и 87, что указывало на возможность существования еще неоткрытых элементов. И действительно, в 1922 г. был открыт элемент гафний, который занял место 72; затем в 1925 г. — рений, занявший место 75.
Элементы, которые должны занять остальные четыре свободных места таблицы, оказались радиоактивными и в природе не найдены, однако их удалось получить искусственным путем. Новые элементы получили названия технеций (порядковый номер 43), прометий (61), астат (85) и франций (87). В настоящее время все клетки периодической системы между водородом и ураном заполнены. Однако сама периодическая система не является завершенной, о чем свидетельствует открытие трансурановых (заурановых) элементов.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 534; Нарушение авторских прав?; Мы поможем в написании вашей работы!