
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение электронной оболочки атома по Бору
|
|
|
|
Как уже указывалось, в своей теории Нильс Бор исходил из ядерной модели атома. Основываясь на положении квантовой теории света о прерывистой, дискретной природе излучения и на линейчатом характере атомных спектров, он сделал вывод, что энергия электронов в атоме не может меняться непрерывно, а изменяется скачками, т. е. дискретно. Поэтому в атоме возможны не любые энергетические состояния электронов, а лишь определенные, «разрешенные» состояния. Иначе говоря, энергетические состояния электронов в атоме квантованы. Переход из одного разрешенного состояния в другое совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения.
Основные положения своей теории Бор сформулировал в виде постулатов (постулат — утверждение, принимаемое без доказательства), содержание которых сводится к следующему:
1. Электрой может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам. Эти орбиты получили название стационарных.
2. Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
3. Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.
Последнее утверждение требует некоторых пояснений. Энергия электрона, вращающегося вокруг ядра, зависит от радиуса орбиты. Наименьшей энергией электрон обладает, находясь на ближайшей к ядру орбите (это так называемое нормальное состояние атома). Для того чтобы перевести электрон на более удаленную от ядра орбиту, нужно преодолеть притяжение электрона к положительно заряженному ядру, что требует затраты энергии. Этот процесс осуществляется при поглощении кванта света.
Соответственно, энергия атома при таком переходе увеличится, он перейдет в возбужденное состояние. Переход электрона в обратном направлении, т. е. с более удаленной орбиты на более близкую к ядру, приведет к уменьшению энергин атома; освободившаяся энергия будет выделена в виде кванта электромагнитного излучения. Если обозначить начальную энергию атома при нахождении электрона на более удаленной от ядра орбите через Ен, а конечную энергию атома для более близкой к ядру орбиты через Ек, то энергия кванта, излучаемого при перескоке электрона, выразится разностью: Е=Ен-Ек. Принимая во внимание уравнение Планка E=hv, получим hv=Ен-Ек, откуда
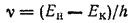
Последнее уравнение позволяет вычислить возможные частоты (или длины волн) излучения, способного испускаться или поглощаться атомом, т. е. рассчитать спектр атома.
Постулаты Бора находились в резком противоречии с положениями классической физики. С точки зрения классической механики электрон может вращаться по любым орбитам, а классическая электродинамика не допускает движения заряженной частицы по круговой орбите без излучения. Но эти постулаты нашли свое оправдание в замечательных результатах, полученных Бором при расчете спектра атома водорода.
Здесь следует отметить, что работа Бора появилась в то время (1913 г.), когда атомные спектры многих элементов были изучены и спектральный анализ нашел уже обширные применения. Так, с помощью спектрального анализа были открыты благородные газы, причем гелий был сначала обнаружен в спектра Солнца и только позже — на Земле. Было ясно, что атомные спектры представляют собой своеобразные «паспорта» элементов. Однако язык этих «паспортов» оставался непонятным; были установлены лишь некоторые эмпирические правила, которые описывали расположение линий в атомных спектрах.
Теория Бора не только объяснила физическую природу атомных спектров как результата перехода атомных электронов с одних стационарных орбит на другие, но и впервые позволила рассчитывать спектры. Расчет спектра простейшего атома — атома водорода, выполненный Бором, дал блестящие результаты: вычисленное положение спектральных линий в видимой части спектра превосходно совпало с их действительным местоположением в спектре. При этом оказалось, что эти линии соответствуют переходу электрона с более удаленных орбит на вторую от ядра орбиту.
Бор не ограничился объяснением уже известных свойств спектра водорода, но на основе своей теории предсказал существование и местоположение неизвестных в то время спектральных серий водорода, находящихся в ультрафиолетовой и инфракрасной областях спектра и связанных с переходом электрона на ближайшую к ядру орбиту и на орбиты, более удаленные от ядра, чем вторая. Все эти спектральные серии были впоследствии экспериментально обнаружены в замечательном согласии с расчетами Бора.
Расчет спектра атома водорода был блестящим успехом теории Бора.
Нильс Бор, выдающийся датский физик, в 1911—1912 гг. работал в лаборатории Резерфорда; с 1916 г. профессор Копенгагенского университета, с 1920 г. до конца жизни возглавлял Институт теоретической физики этого университета.

Нильс Бор (1885-1962)
Бор — глава крупной научной школы в области теоретической физики, автор первоначальной квантовой теории строения атома (1913—1916 гг.), послужившей исходным пунктом современной кваптовомеханическон теории строения атома; в 1913 г. установил принцип соответствия между классическими и квантовыми представлениями; ему принадлежат также работы по теоретическому объяснению периодического закона Д. И. Менделеева и по теории атомного ядра. В 1922 г. награжден Нобелевской премией. В 1929 г. избран иностранным членом Академии иаук СССР,
И все же триумф теории Бора нельзя было считать полным. Она страдала внутренней противоречивостью, которую прекрасно сознавал сам Бор: наряду с постулатами, противоречившими законам механики и электродинамики, в теории Бора эти законы использовались для расчета сил, действующих на электрон в атоме. Оставался неясным и ряд вопросов, связанных с самими постулатами Бора, например: где находится электрон в процессе перехода с одной орбиты на другую? Как вытекает из теории относительности, ни один физический процесс не может распространяться со скоростью, превышающей скорость света. Поэтому переход электрона на новую орбиту, отделенную некоторым расстоянием от исходной, не совершается мгновенно, а длится некоторое время. В течение этого времени электрон должен находиться где-то между исходной и конечной орбитами. Но как раз такие промежуточные состояния «запрещаются» теорией, поскольку постулируется возможность пребывания электрона только на стационарных орбитах.
Наконец, несмотря на усовершенствования, внесенные в теорию Бора немецким физиком А. Зоммерфельдом и другими учеными (была принята во внимание возможность движения электрона в атоме не только по круговым, но и по эллиптическим орбитам, по-разному расположенным в пространстве), эта теория не смогла объяснить некоторых важных спектральных характеристик многоэлектронных атомов и даже атома водорода. Например, оставалась неясной причина различной интенсивности линий в атомном спектре водорода.
Все же теория Бора была важным этапом в развитии представлений о строении атома; как и гипотеза Планка — Эйнштейна о световых квантах (фотонах), она показала, что нельзя автоматически распространять законы природы, справедливые для больших тел — объектов макромира, на ничтожно малые объекты микромира — атомы, электроны, фотоны.
Поэтому и возникла задача разработки новой физической теории, пригодной для непротиворечивого описания свойств и поведения объектов микромира. При этом в случае макроскопических тел выводы этой теории должны совпадать с выводами классической механики и электро-динамики (так называемый принцип соответствия, выдвинутый Бором).
Эта задача была решена в 20-х годах XX века, после возникновения и развития новой отрасли теоретической физики — квантовой или волновой механики.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1076; Нарушение авторских прав?; Мы поможем в написании вашей работы!