
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атомных ядер. Изотопы
|
|
|
|
Согласно современным представлениям, атомные ядра состоят из протонов и нейтронов. Протон (от греч. «протос» — первый) — элементарная частица, обладающая массой 1,00728 а. е. м. и положительным зарядом, равным по абсолютной величине заряду электрона. Нейтрон также представляет собой элементарную частицу, но не обладающую электрическим зарядом; масса нейтрона составляет 1,00867 а. е. м. Протон принято обозначать символом,  , нейтрон — n.
, нейтрон — n.
Сумма числа протонов и числа нейтронов, содержащихся в ядре атома, называется массовым числом атома (ядра). Поскольку и протон, и нейтрон имеют массу, очень близкую к атомной единице массы, то массовое число атома приближенно выражает его атомную массу. Но число протонов равно числу положительных зарядов, т. е. порядковому номеру элемента; следовательно, число нейтронов равняется разности между массовым числом и порядковым номером элемента.
Между образующими ядро частицами действуют два вида сил: электростатические силы взаимного отталкивания положительно заряженных протонов и силы притяжения между всеми частицами, входящими в состав ядра, называемые ядерными силами. С возрастанием расстояния между взаимодействующими частицами ядерные силы убывают гораздо более резко, чем силы электростатического взаимодействия. Поэтому их действие заметно проявляется только между очень близко расположенными частицами. Но при ничтожных расстояниях между частицами, составляющими атомное ядро, ядерные силы притяжения превышают силы отталкивания, вызываемые присутствием одноименных зарядов, и обеспечивают устойчивость ядер.
Не всякое сочетание протонов с нейтронами устойчиво. Ядра атомов более легких элементов устойчивы, когда число нейтронов примерно равно числу протонов. По мере увеличения заряда ядра относительное число нейтронов, необходимых для устойчивости, растет, достигая в последних рядах периодической системы значительного перевеса над числом протонов. Так, у висмута (ат. масса 209) на 83 протона приходится уже 126 нейтронов; ядра более тяжелых элементов вообще неустойчивы.
Масса ядра атома лишь приближенно равна сумме масс протонов и нейтронов, образующих ядро. Если, приняв во внимание точные величины масс протона и нейтрона, подсчитать, чему должны равняться массы различных ядер, то получается некоторое расхождение с величинами, найденными экспериментальным путем.
Вычислим, например, массу ядра гелия, состоящего из двух протонов и двух нейтронов. Сумма масс протонов и нейтронов, образующих ядро гелия, равна
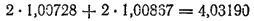
тогда как в действительности масса ядра гелия равна 4,0026, т. е. примерно на 0,03 а. е. м. меньше.
Аналогичные результаты получаются при подсчете масс других ядер. Оказывается, что масса ядра всегда меньше суммы масс всех составляющих ядро частиц, т. е. всех протонов и нейтронов, рассматриваемых отделенными друг от друга. Это явление получило название дефекта массы.
Чем же объяснить уменьшение массы при образовании атомных ядер? Как уже говорилось в § 4, из теории относительности вытекает связь между массой и энергией, выражаемая уравнением Эйнштейна  . Из этого уравнения следует, что каждому изменению массы должно отвечать и соответствующее изменение энергии. Если при образовании атомных ядер происходит заметное уменьшение массы, это значит, что одновременно выделяется огромное количество энергии.
. Из этого уравнения следует, что каждому изменению массы должно отвечать и соответствующее изменение энергии. Если при образовании атомных ядер происходит заметное уменьшение массы, это значит, что одновременно выделяется огромное количество энергии.
Дефект массы при образовании ядра атома гелия составляет 0,03 а. е. м., а при образовании 1 моля атомов гелия — 0,03 г.  . Согласно уравнению Эйнштейна, это соответствует выделению
. Согласно уравнению Эйнштейна, это соответствует выделению  энергии. Чтобы составить себе представление о колоссальной величине этой энергии, достаточно указать, что она примерно равна той энергии, которую может дать в течение часа электростанция, равная по мощности Днепрогэсу.
энергии. Чтобы составить себе представление о колоссальной величине этой энергии, достаточно указать, что она примерно равна той энергии, которую может дать в течение часа электростанция, равная по мощности Днепрогэсу.
Величина энергии, выделяющейся при образовании данного ядра из протонов и нейтронов, называется энергией связи ядра и характеризует его устойчивость: чем больше величина выделившейся энергии, тем устойчивее ядро.
Ядра всех атомов данного элемента имеют одинаковый заряд, т. е. содержат одинаковое число протонов. Но число нейтронов в ядрах этих атомов может быть различным. Атомы, обладающие одинаковым зарядом ядра (и следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом), называют изотопами. Так, природный хлор состоит из двух изотопов с массовыми числами 35 и 37, магний — из трех изотопов с массовыми числами 24, 25 и 26.
Для обозначения изотопов пользуются обычными символами соответствующих элементов, добавляя к ним слева вверху индекс, указывающий массовое число изотопа. Так, изотопы хлора обозначают  и
и  , изотопы магния —
, изотопы магния —  и
и  и т. д. При необходимости слева внизу ставят индекс, указывающий порядковый номер (заряд ядра) изотопа, например
и т. д. При необходимости слева внизу ставят индекс, указывающий порядковый номер (заряд ядра) изотопа, например  и т. д.
и т. д.
В настоящее время изучен состав всех изотопов природных химических элементов. Установлено, что, как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин. Так, природный хлор на  состоит из изотопа
состоит из изотопа  и на
и на  из изотопа
из изотопа  в результате средняя атомная масса хлора равна 35,453.
в результате средняя атомная масса хлора равна 35,453.
Выше говорилось, что химические свойства изотопов тождественны. Это значит, что если и существует некоторое различие между изотопами в отношении их химических свойств, то оно так мало, что практически не обнаруживается.
Исключение составляют изотопы водорода  и
и  . Вследствие огромной относительной разницы в их атомных массах (масса атома одного изотопа вдвое больше массы атома другого изотопа) свойства этих изотопов заметно различаются. Изотоп водорода с массовым числом 2 называют дейтерием и обозначают символом D. Дейтерий содержится в обычном водороде в количестве около
. Вследствие огромной относительной разницы в их атомных массах (масса атома одного изотопа вдвое больше массы атома другого изотопа) свойства этих изотопов заметно различаются. Изотоп водорода с массовым числом 2 называют дейтерием и обозначают символом D. Дейтерий содержится в обычном водороде в количестве около  . Известен также радиоактивный изотоп водорода
. Известен также радиоактивный изотоп водорода  — тритий (период полураспада около 12 лет), получаемый только искусственным путем; его обозначают символом Т.
— тритий (период полураспада около 12 лет), получаемый только искусственным путем; его обозначают символом Т.
Открытие изотопов потребовало пересмотра понятия химический элемент. Поэтому Международная комиссия по атомным весам в 1923 г. постановила считать, что химический элемент определяется атомным порядковым номером и может состоять как из одинаковых, так и из различных по массе атомов.
Таким образом, химический элемент — это вид атомов, характеризующийся определенной величиной положительного заряда ядра.
Изотопные индикаторы. При изучении механизма химических и биологических процессов широко используют так называемые изотопные индикаторы, или «меченые атомы». Применение их основано на том, что при химических превращениях можно проследить пути перехода интересующего нас элемента, измерив концентрацию одного из его изотопов в каком-либо из взятых для реакции веществ. Так как все изотопы одного и того же элемента ведут себя при химических реакциях практически тождественно, то по изменению состава изотопов данного элемента в тех или иных продуктах реакции можно проследить, куда именно он перешел.
Так, применение тяжелого изотопа кислорода  при изучении процесса усвоения диоксида углерода растениями (для опытов пользовались диоксидом углерода и водой, обогащенными
при изучении процесса усвоения диоксида углерода растениями (для опытов пользовались диоксидом углерода и водой, обогащенными  ) показало, что процесс идет согласно схемам, в которых изотоп
) показало, что процесс идет согласно схемам, в которых изотоп  отмечен звездочкой.
отмечен звездочкой.
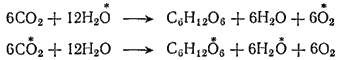
Таким образом было установлено, что возвращаемый растениями в атмосферу кислород целиком берется из воды, а не из диоксида углерода.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1401; Нарушение авторских прав?; Мы поможем в написании вашей работы!