
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы образования ковалентной связи
|
|
|
|
Как уже говорилось, общая электронная пара, осуществляющая ковалентную связь, может образоваться за счет неспаренных электронов, имеющихся в невозбуждеиных взаимодействующих атомах. Это происходит, например, при образовании таких молекул, как  . Здесь каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара — возникает ковалентная связь.
. Здесь каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара — возникает ковалентная связь.
В невозбужденном атоме азота имеются три неспаренных электрона:
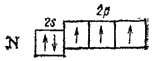
Следовательно, за счет неспаренных электронов атом азота может участвовать в образовании трех ковалентных связей. Это и происходит, например, в молекулах  или
или  , в которых ковалентность азота равна 3.
, в которых ковалентность азота равна 3.
Однако число ковалентных связей может быть и больше числа имеющихся у невозбужденного атома иеспаренных электронов. Так, в нормальном состоянии внешний электронный слой атома углерода имеет структуру, которая изображается схемой:

За счет имеющихся неспаренных электронов атом углерода может образовать две ковалентные связи. Между тем для углерода характерны соединения, в которых каждый его атом связан с соседними атомами четырьмя ковалентными связями (например,  и т. д.). Это оказывается возможным благодаря тому, что при затрате некоторой энергии можно один из имеющихся в атоме
и т. д.). Это оказывается возможным благодаря тому, что при затрате некоторой энергии можно один из имеющихся в атоме  -электронов перевести на подуровень
-электронов перевести на подуровень  в результате атом переходит в возбужденное состояние, а число неспаренных электронов возрастает. Такой процесс возбуждения, сопровождающийся «распариванием» электронов, может быть представлен следующей схемой, в которой возбужденное состояние отмечено звездочкой у символа элемента:
в результате атом переходит в возбужденное состояние, а число неспаренных электронов возрастает. Такой процесс возбуждения, сопровождающийся «распариванием» электронов, может быть представлен следующей схемой, в которой возбужденное состояние отмечено звездочкой у символа элемента:

Теперь во внешнем электронном слое атома углерода находятся четыре неспаренных электрона; следовательно, возбужденный атом углерода может участвовать в образовании четырех ковалентных связей. При этом увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на перевод атома в возбужденное состояние.
Если возбуждение атома, приводящее к увеличению числа неспаренных электронов, связано с очень большими затратами энергии, то эти затраты не компенсируются энергией образования новый связей; тогда такой процесс в целом оказывается энергетически невыгодным. Так, атомы кислорода и фтора не имеют свободных орбиталей во внешнем электронном слое:
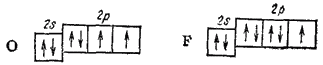
Здесь возрастание числа неспаренных электронов возможно только путем перевода одного из электронов на следующий энергетический уровень, т. е. в состояние  . Однако такой переход сопряжен с очень большой затратой энергии, которая не покрывается энергией, выделяющейся при возникновении новых связей. Поэтому за счет неспаренных электронов атом кислорода может образовать не больше двух ковалентных связей, а атом фтора — только одну. Действительно, для этих элементов характерна постоянная ковалентность, равная двум для кислорода и единице — для фтора.
. Однако такой переход сопряжен с очень большой затратой энергии, которая не покрывается энергией, выделяющейся при возникновении новых связей. Поэтому за счет неспаренных электронов атом кислорода может образовать не больше двух ковалентных связей, а атом фтора — только одну. Действительно, для этих элементов характерна постоянная ковалентность, равная двум для кислорода и единице — для фтора.
Атомы элементов третьего и последующих периодов имеют во внешнем электронном слое  -подуровень, на который при возбуждении могут переходить s- и р-электроны внешнего слоя. Поэтому здесь появляются дополнительные возможности увеличения числа неспаренных электронов. Так, атом хлора, обладающий в невозбужденном состоянии одним неспаренным электроном,
-подуровень, на который при возбуждении могут переходить s- и р-электроны внешнего слоя. Поэтому здесь появляются дополнительные возможности увеличения числа неспаренных электронов. Так, атом хлора, обладающий в невозбужденном состоянии одним неспаренным электроном,
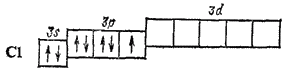
может быть переведен, при затрате некоторой энергии, в возбужденные состояния  , характеризующиеся тремя, пятью или семью неспаренными электронами;
, характеризующиеся тремя, пятью или семью неспаренными электронами;
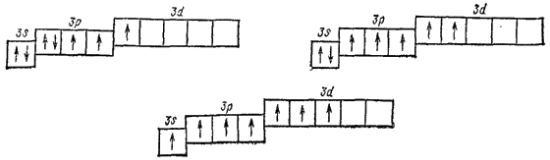
Поэтому, в отличие от атома фтора, атом хлора может участвовать в образовании не только одной, но также трех, пяти или семи ковалентных связей. Так, в хлористой кислоте  ковалентность хлора равна трем, в хлорноватой кислоте
ковалентность хлора равна трем, в хлорноватой кислоте  — пяти, а в хлорной кислоте
— пяти, а в хлорной кислоте  — семи. Аналогично атом серы, также обладающий незанятым
— семи. Аналогично атом серы, также обладающий незанятым  -подуровнем, может переходить в возбужденные состояния с четырьмя или шестью неспаренными электронами и участвовать, следовательно, в образовании не только двух, как у кислорода, но также четырех или шести ковалентных связей. Этим можно объяснить существование соединений, в которых сера проявляет ковалентность, равную четырем
-подуровнем, может переходить в возбужденные состояния с четырьмя или шестью неспаренными электронами и участвовать, следовательно, в образовании не только двух, как у кислорода, но также четырех или шести ковалентных связей. Этим можно объяснить существование соединений, в которых сера проявляет ковалентность, равную четырем  или шести
или шести  .
.
Во многих случаях ковалентные связи возникают и за счет спаренных электронов, имеющихся во внешнем электронном поле атома. Рассмотрим, например, электронную структуру молекулы аммиака:
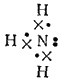
Здесь точками обозначены электроны, первоначально принадлежавшие атому азота, а крестиками — принадлежавшие атомам водорода. Из восьми внешних электронов атома азота шесть образуют три ковалентные связи и являются общими для атома азота и атомов водорода. Но два электрона принадлежат только азоту к образуют неподеленную электронную пару. Такая пара электронов тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое этого атома есть свободная орбиталь. Незаполненная  -орбиталь имеется, например, у нона водорода
-орбиталь имеется, например, у нона водорода  , вообще лишенного электронов:
, вообще лишенного электронов:
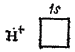
Поэтому при взаимодействии молекулы  с ионом водорода между ними возникает ковалентная связь; неподеленная пара электронов атома азота становится общей для двух атомов, в результате чего образуется ион аммония
с ионом водорода между ними возникает ковалентная связь; неподеленная пара электронов атома азота становится общей для двух атомов, в результате чего образуется ион аммония  :
:

Здесь ковалентная связь возникла за счет пары электронов, (электронной пары), и свободной орбитали другого атома (акцептора электронной пары) первоначально принадлежавшей одному атому (донору электронной пары).
Такой способ образования ковалентной связи называется донорно-акцепторным. В рассмотренном примере донором электронной пары служит атом азота, а акцептором — атом водорода.
Опытом установлено, что четыре связи  в ионе аммония во всех отношениях равноценны. Из этого следует, что связь, образованная донорно-акцепторным способом, не отличается по своим свойствам от ковалентной связи, создаваемой за счет неспаренных электронов взаимодействующих атомов.
в ионе аммония во всех отношениях равноценны. Из этого следует, что связь, образованная донорно-акцепторным способом, не отличается по своим свойствам от ковалентной связи, создаваемой за счет неспаренных электронов взаимодействующих атомов.
Другим примером молекулы, в которой имеются связи, образованные донорно-акцепторным способом, может служить молекула оксида азота  .
.
Раньше структурную формулу этого соединения изображали следующим сбразом:
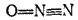
Согласно этой формуле центральный атом азота соединен с соседними атомами пятью ковалентными связями, так что в его внешнем электронном слое находятся десять электронов (пять электронных пар). Но такой вывод противоречит электронной структуре атома азота, поскольку его наружный L-слой содержит всего четыре орбитали (одну s- и три р-орбитали) и не может вместить более восьми электронов. Поэтому приведенную структурную формулу нельзя признать правильной.
Рассмотрим электронную структуру оксида азота  , причем электроны отдельных атомов будем попеременно обозначать точками или крестиками. Атом кислорода, имеющий два неспаренных электрона, образует две ковалентных связи с центральным атомом азота:
, причем электроны отдельных атомов будем попеременно обозначать точками или крестиками. Атом кислорода, имеющий два неспаренных электрона, образует две ковалентных связи с центральным атомом азота:

За счет неспаренного электрона, оставшегося у центрального атома азота, последний образует ковалентную связь со вторым атомом азота:
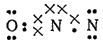
Таким образом, внешние электронные слои атома кислорода и центрального атома азота оказываются заполненными: здесь образуются устойчивые восьмиэлектронные конфигурации. Но во внешнем электронном слое крайнего атома азота размещено только шесть электронов; этот атом может, следовательно, быть акцептором еще одной электронной пары. Соседний же с ним центральный атом азота обладает неподеленной электронной парой и может выступать в качестве донора.
Это приводит к образованию по донорно-акцепторному способу еще одной ковалентной связи между атомами азота:

Теперь каждый из трех атомов, составляющих молекулу  , обладает устойчивой восьмиэлектронной структурой внешнего слоя. Если ковалентную связь, образованную донорно-акцепторным способом, обозначить, как это принято, стрелкой, направленной от атома-донора к атому-акцептору, то структурную формулу оксида азота (I) можно представить следующим образом:
, обладает устойчивой восьмиэлектронной структурой внешнего слоя. Если ковалентную связь, образованную донорно-акцепторным способом, обозначить, как это принято, стрелкой, направленной от атома-донора к атому-акцептору, то структурную формулу оксида азота (I) можно представить следующим образом:
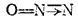
Таким образом, в оксиде азота  ковалентность центрального атома азота равна четырем, а крайнего — двум.
ковалентность центрального атома азота равна четырем, а крайнего — двум.
Рассмотренные примеры показывают, что атомы обладают разнообразными возможностями для образования ковалентных связей. Последние могут создаваться и за счет неспаренных электронов невозбужденного атома, и за счет неспаренных электронов, появляющихся в результате возбуждения атома («распаривания» электронных пар), и, наконец, по донорно-акцепторному способу. Тем не менее, общее число ковалентных связей, которые способен образовать данный атом, ограничено. Оно определяется общим числом валентных орбиталей, т. е. тех орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Квантово-механический расчет показывает, что к подобным орбиталям принадлежат s- и р-орбитали внешнего электронного слоя и  -орбитали предшествующего слоя; в некоторых случаях, как мы видели на примерах атомов хлора и серы, в качестве валентных орбиталей могут использоваться и
-орбитали предшествующего слоя; в некоторых случаях, как мы видели на примерах атомов хлора и серы, в качестве валентных орбиталей могут использоваться и  -орбитали внешнего слоя.
-орбитали внешнего слоя.
Атомы всех элементов пторого периода имеют во внешнем электронном слое четыре орбитали при отсутствии  -орбиталей в предыдущем слое. Следовательно, на валентных орбиталях этих атомов может разместиться не более восьми электронов. Это означает, что максимальная ковалентность элементов второго периода равна четырем.
-орбиталей в предыдущем слое. Следовательно, на валентных орбиталях этих атомов может разместиться не более восьми электронов. Это означает, что максимальная ковалентность элементов второго периода равна четырем.
Атомы элементов третьего и последующих периодов могут использовать для образования ковалентных связей не только s- и  , но также и
, но также и  -орбитали. Известны соединения
-орбитали. Известны соединения  -элементов, в которых в образовании ковалентных связей участвуют s- и р-орбитали внешнего электронного слоя и все пять
-элементов, в которых в образовании ковалентных связей участвуют s- и р-орбитали внешнего электронного слоя и все пять  -орбиталей предшествующего слоя; в подобных случаях ковалентность соответствующего элемента достигает девяти.
-орбиталей предшествующего слоя; в подобных случаях ковалентность соответствующего элемента достигает девяти.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей получила название насыщаемости ковалентной связи.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 887; Нарушение авторских прав?; Мы поможем в написании вашей работы!