
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первое и второе начала термодинамики для элементарного процесса. Второе начало термодинамики в формулировке Клаузиуса
|
|
|
|
Энтропия.
Второе начало термодинамики в формулировке Клаузиуса
Уравнение политропы и адиабаты для идеального газа.
Уравнение адиабатического процесса.
Уравнение адиабатического процесса (C=0):
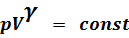 (1)
(1)
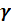 – показатель адиабата
– показатель адиабата
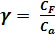 (2)
(2)
Уравнение политропического процесса имеет след. вид:
C=const;
pVn = const (1)
n – показатель политропности
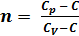 (2)
(2)
Уравнение адиабатического процесса:
C=0
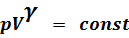 (1)
(1)
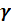 – показатель адиабата
– показатель адиабата
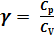 (2)
(2)
Энтропия – это ф-я состояния ТДС, которая определяется след. образом:
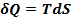 (1)
(1)
Ф-я состояния ТДС, определяемая с помощью дифференциального соотношения 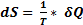 (2) наз-ся энтропией.
(2) наз-ся энтропией.
Элементарный процесс – передача энергии системе, связанной с бесконечным изменением её внутренних и внешних параметров.
Элементарный процесс записывается след. образом:
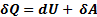 (1) – это закон сохранения энергии
(1) – это закон сохранения энергии
Закон сохранения энергии (1) – это первое начало термодинамики для элементарного процесса.
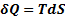
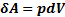
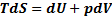 (2) – объединяет 1 и 2 начало.
(2) – объединяет 1 и 2 начало.
Уравнение (2), объединяющее 1 и 2 начало ТД наз-ся основным уравнением термодинамики для равновесных ТД процессов.
44. Термодинамический потенциал – внутренняя энергия U(S,V).
Все термодинамические потенциалы выводятся из первого и второго начал ТД.
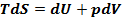 (1)
(1)
Первый потенциал внутренняя энергия U.
Пусть нам известна ф-я:
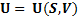 (2)
(2)
Из (1) следует, что:
 (3)
(3)
 V (4)
V (4)
 s (5)
s (5)
Внутренняя энергия U в переменных S и V, наз-ся ТД-им потенциалом.
45. Термодинамический потенциал – свободная энергия U(S,V).
U, как потенциал не удобен, т.к. он содержит S. Следовательно так, что было dT, dV.
Left = TdS – d(TS) = TdS – dT*S – TdS = -SdT
Right = dU + pdV – d(TS) = d(U - TS) + pdV
Введём новую ф-ю F:
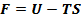 (1)
(1)
Приравниваем правую часть:
-SdT = dF + pdV
переносим:
dF = -SdT – pdV (2)
найдём S:
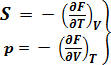 (3)
(3)
 (4)
(4)
Ф-я F = от F(t), также является термодинамическим и наз-ся свободной энергией.
46. Термодинамический потенциал – потенциал Гиббса U(S,V).
Переменные Т и р:
Добавим к обеим частям формулы dF = -SdT – pdV (1) + d(pV)
Получим:
d(F + pV) = -SdT – Vdp (2)
Введём новую ф-ю Ф:
Ф = F + pV (3)
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 294; Нарушение авторских прав?; Мы поможем в написании вашей работы!