
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса. Внутренняя энергия реального газа
|
|
|
|
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
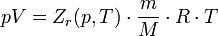
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М —молярная масса; R — газовая постоянная.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
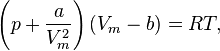
где
· 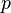 — давление,
— давление,
·  — молярный объём,
— молярный объём,
·  — абсолютная температура,
— абсолютная температура,
· 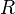 — универсальная газовая постоянная.
— универсальная газовая постоянная.
Уравнение Ван–дер–Ваальса после несложных преобразований можно представить в виде уравнения третьей степени относительно объёма:

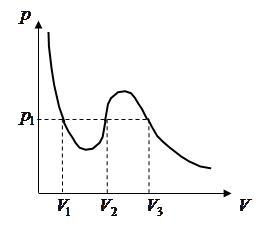
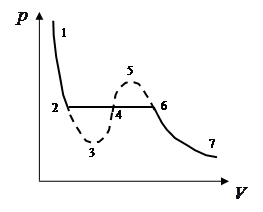 Участки 1–2 (соответствует жидкому состоянию) и 6–7 (соответствует газообразному состоянию) на обеих изотермах качественно совпадают.
Участки 1–2 (соответствует жидкому состоянию) и 6–7 (соответствует газообразному состоянию) на обеих изотермах качественно совпадают.
Состояния, отвечающие на кривой точкам 3–4–5, не могут существовать, т.к. они соответствуют факту, что с ростом давления растет и объём, что невозможно. Состояния с такими необычными свойствами должно быть абсолютно неустойчивым и в действительности не наблюдаются. Состояния, соответствующие участком кривой 2–3 и 5–6, должны существовать, т.к. они являются продолжениями участков 1–2 и 6–7. Состояние 2–3 называют перегретой жидкостью (не совсем удачный термин), а состояние 6–5 – перенасыщенным (переохлажденным) паром.
Внутренняя энергия реального газа

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2963; Нарушение авторских прав?; Мы поможем в написании вашей работы!