
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет 27. Дайте определение гидролиза соли. Типы гидролиза
|
|
|
|
Гидроиз солей – процесс взаимодействия ионов соли с ионами воды, в результате чего образуется слабо диссоциирующий электролит и смещается кислотность среды. Механизм реакций гидролиза различных солей отличается большим разнообразием и сложностью.
Если соль образована слабым основанием и сильной кислотой (CuCl2, FeSO4, Mn(NO3)), то в этом случае гидролиз идет по катиону соли.
Если соль образована слабой кислотой и сильным основанием (Na2S, K2CO3, Bi(NO3)3) то в этом случае гидролиз идет по аниону.
Если соль образована слабой кислотой и слабым основанием ((NH4)2 S, Cu2S, Pb(NO2)2), то гидролиз идет по катиону, и по аниону.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, т.к. ионы этих солей не могут образовывать с ионами воды слабых или труднорастворимых электролитов. Это такие соли, как: NaCl, KBr, KNO3, Na2SO4, BaCl2.
Ступенчатый гидролиз. Многоосновные кислоты диссоциируют поступеням, поэтому и их соли также гидролизуются ступенчато. Причем число ступеней гидролиза зависит от основности кислоты, т.е. числа атомов водорода в её молекуле (Na2SiO3, K2S, Ca3(PO4)2). Если соли образованы слабыми основаниями многовалентных металлов и сильными кислотами, то число ступеней зависит от кислотности слабого основания, т.е. от числа OН- – групп в его молекуле. В результате гидролиза на первых ступенях образуются основные соли вместо оснований и сильные кислоты. Примеры таких солей: Al2(SO4)3, ZnBr2, Fe(NO3)3, SbCl.
Полный (или необратимый) гидролиз. Если кислота и основание, образующие соль, не только слабые электролиты, но малорастворимы или неустойчивы и разлагаются с бразованием летучих продуктов, т. е. хотя бы один из продуктов уходит из сферы реакции, то гидролиз соли часто протекает необратимо.
Билет 28. Дайте определение ОВР. Основные понятия: степень окисления, процессы окисления, восстановления. Классификация ОВР. Привести примеры реакций каждого типа.Каковы группы веществ – типичных окислитеей и восстановиелей? Приведите примеры.
Все химические реакции можно разделить на два типа. К первым из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ. Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Степень окисления - это условный заряд атома в молекуле, исходя из предположения о том, что молекула состоит только из ионов. Вещества, которые присоединяют электроны называются окислителями, а вещества, которые отдают их - восстановителями. В процессе реакции окислитель восстанавливается, а восстановитель окисляется.
Различают три типа ОВР:
Межмолекулярного окисления-восстановления, у которых окислитель и восстановитель находятся в молекулах разных веществ. Этот тип реакций наиболее распространённый и оставляет самую обширную группу: 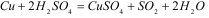
Внутримолекулярного окисления – восстановления, в которых и окислитель, и восстановитель находятся в одной и той же молекуле. В этом случае атом с большим значением степени окисления будет окислять другой атом с меньшим значением степени окисления. К ним относятся реакции термического разложения веществ, например:
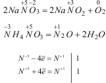
Реакции диспропорционирования (или самоокисления -самовосстановления), в которых один и тот же элемент является и окислителем, и восстановителем: 
Типичными окислителями являются: галогены, ионы благородных металлов, сипохлориты, хлораты, прехлораты, анод при электролизе.
Типичными восстаносителями являются: металлы, водород, уголь, альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза, катод при электролизе.
Билет 29. Механизм возникновения электродного потенциала на границе раздела фаз. Стандартный электродный потенциал и его определение при помощи водородного электрода. Реальный электродный потенциал. Уравнение Нернста.
Металл можно представить как равновесную систему, состоящую из атомов металла,его ионов и свободных валентных электронов. Поэтому в зависимости от химической природы металлов при погружении их в воду или раствор электролита одни из них заряжаются отрицательно – это активные металлы, а другие - положительно, это неактивные металлы. При погружении активного металла в воду или какой – либо электролит под действием полярных молекул воды с поверхности такого металла отрываются ионы, которые переходят в раствор и гидратируются. В результате этого на поверхности металла оказывается избыток электронов и, следовательно, поверхность его заряжается отрицательно. Гидратированные катионы вследствии притяжения размещаются вблизи отрицательно заряженной поверхности металла, образуя двойной электрический слой. Устанавливается подвижное равновесие: какие – то ионы металла переходят в раствор и в то же время такое же количество ионов из раствора оседает на металле, т.е. этот процесс является обратимым. Когда установится равновесие на границе контакта металл – раствор возникает определенная разность потенциалов, которую называют равновесным электродным потенциалом металла в растворе и обозначают буквой φ.
Если пластинку любого металла погрузить в раствор его соли, содержащей 1 моль ионов металла в 1 л раствора, и соединить с водородным электродом, то такая система будет представлять собой гальванический элемент, электродвижущую силу (ЭДС) которого легко измерить. Эта ЭДС и называется стандартным электродным потенциалом данного металла в растворе и обозначается φ0. Поскольку потенциал стандартного водородного электрода условно принят равным нулю, то стандартные потенциалы тех металлов, которые отдают электроны водородному электроду имеют знак «минус», а те металлы, которые принимают электроны от водородного электрода – знак «плюс».Зависимость электродных потенциалов φ от концентрации веществ, участвующих в электродных процессах, и от температуры выражается уравнением Нернста:  . Где φ0 - стандартный электродный потенциал (В), R – универсальная газовая постоянная, T – температура (К), F =96500 Кл – число Фарадея, n – число электронов, участвующих в электродном процессе, СMе+n - концентрация ионов данного металла в растворе.
. Где φ0 - стандартный электродный потенциал (В), R – универсальная газовая постоянная, T – температура (К), F =96500 Кл – число Фарадея, n – число электронов, участвующих в электродном процессе, СMе+n - концентрация ионов данного металла в растворе.
Билет 30. Простейший гальванический элемент: его строение и функционированее, схематическое обозначенеи, расчет ЭДС. Дайте определение Катода и анода в электрической системе.
Простой гальванический элемнет, который называется элемент Даниэля-Яуоби состоит из двух электродов (цинк и купрум) погруженные в соответствующие растворы сульфатов цинка и купрума, которые соеденины электрическим мостиком или полупроницаемой мембраной. Элементы соеденнеы между собой металическими проводникам и через гальванометр. Их полярность в первом приближении определяется по значениям стандартных потенциалов, следовательно, цинковый электрод заряжен отрицательно и является анодом, а медный – положительно – катодом. На аноде протекает процесс окисления, в результате которого цинк переходит в раствор в виде катионов. При этом происходит растворение цинкового электрода, а остающиеся на нем электроны сообщают ему отрицательный заряд. На катоде совершается процесс восстановления ионов меди, подходящих к медной пластинке и осаждающихся на ней. В результате этого процесса расходуется некоторое количество свободных электронов медной пластинки и она приобретает положительный заряд. Суммарный электрохимический окислительно-восстановительный процесс в гальваническом элементе представляет собой совокупность анодного и катодного процессов. Благодаря ему в гальваническом элементе возникает движение ионов во внутренней цепи и электронов во внешней цепи т.е. электрический ток.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором его соли обозначается одной вертикальной чертой, а граница между растворами электролитов обозначается двумя вертикальными чертами. Например, гальванический элемент Даниэля-Якоби схематически можно изобразить в виде:
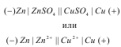
Разность двух электродных потенциалов, отвечающих данной электрохимической реакции, называется ЭДС гальванического элемента. При этом следует иметь в виду, что ЭДС всегда положительная величина, поэтому при вычислении ЭДС из более положительного электродного потенциала вычитают менее положительный. Таким образом, ЭДС гальванического элемента является его основной электрической характеристикой в том случае, когда элемент находится в равновесном состоянии. Чем больше разница в значениях стандартных электродных потенциалов двух металлов, тем больше ЭДС построенного из них гальванического элемента.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2223; Нарушение авторских прав?; Мы поможем в написании вашей работы!