
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы приготовления растворов
|
|
|
|
Существует несколько способов приготовления растворов. По способу приготовления различают первичные и вторичные стандартные растворы.
1.
По точной навеске готовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
а) состав их должен строго соответствовать химической формуле;
б) вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
в) величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом. Основные этапы работы:
рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г по одной из формул:
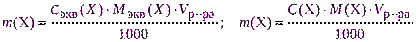 ;
;
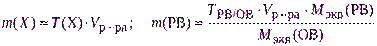 ,
,
где V р-ра – объем раствора, см3;
взвешивают точную навеску на аналитических весах;
взвешенную навеску количественно переносят в мерную колбу вместимостью, равной V р-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают, используя указанные выше формулы, например:
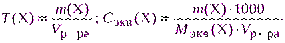 ,
,
где V р-ра – объем раствора, см3; m( Х ) – практическая навеска, г.
2.
По приблизительной навеске готовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
С экв 1· V 1 = C экв 2· V 2 (2.16)
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными.
3.
Из фиксанала (норма-дозы, стандарт-титра) готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество n экв вещества в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу (2.6).
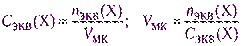 (2.17)
(2.17)
4.
Разбавлением концентрированных растворов готовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации, все расчеты ведут с точностью не более чем до 0,01, точную концентрацию устанавливают титрованием и рассчитывают по формуле (2.16).
Пример. Сколько грамм хлорида калия KCl потребуется для приготовления 2 дм3 раствора:
а) с массовой долей, равной 30% и плотностью 1,110 г/см3;
б) с титром, равным 0,001841 г/см3;
в) с молярной концентрацией эквивалента, равной 0,2000 моль/дм3.
Решение.
| Дано: ω (KCl) = 30% | а) Массу хлорида калия рассчитаем, используя формулу (2.11): |
| V р-ра= 2 дм3 = 2000 см3 ρ р-ра = 1,110 г/см3 | 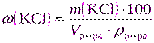
|
| С экв(KCl) = 0,2000 моль/дм3 T (KCl) = 0,001841 г/см3 | 
|
| m(KCl) =? |
б) Для расчета используем формулу (2.12):
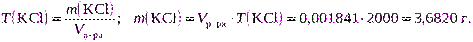
в) Для расчета можно использовать формулу (2.7):
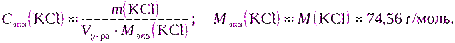
m (KCl) = C экв(KCl) · V р-ра · M экв(KCl) = 0,2000·2·74,56 = 29,8240 г.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 19910; Нарушение авторских прав?; Мы поможем в написании вашей работы!