
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Идеальные газы
|
|
|
|
Адиабатический процесс
Изотермический процесс
Изотермический процесс (от греч. «термос» — тёплый, горячий) — процесс изменения состояния термодинамической системы при постоянной температуре (T = const). Изотермический процесс описывается законом Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Адиабатический процесс — процесс изменения состояния термодинамической системы при постоянной энтропии (S = const). В таком процессе не происходит теплообмена газа с окружающей средой. Газ в этом процессе описывается следующим уравнением:
pV γ = const
где γ — показатель адиабаты, определяемый типом газа.
- Дать понятие внутренней энергии идеального газа. Записать формулу внутренней энергии идеального одноатомного газа, дать ее анализ. Способы изменения внутренней энергии идеального газа. Формула работы идеального газа при постоянном давлении, ее анализ.
Вну́тренняя эне́ргия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Следовательно, внутренняя энергия складывается из кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между ними и внутримолекулярной энергии.
Согласно закону Джоуля, выведенному эмпирически, внутренняя энергия идеального газа не зависит от давления или объёма. Исходя из этого факта, можно получить выражение для изменения внутренней энергии идеального газа. По определению молярной теплоёмкости при постоянном объёме, 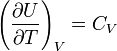 . Так как внутренняя энергия идеального газа является функцией только от температуры, то
. Так как внутренняя энергия идеального газа является функцией только от температуры, то
 .
.
Эта же формула верна и для вычисления изменения внутренней энергии любого тела, но только в процессах при постоянном объёме (изохорных процессах); в общем случае CV (T, V) является функцией и температуры, и объёма.
Если пренебречь изменением молярной теплоёмкости при изменении температуры, получим:
Δ U = ν CV Δ T,
где ν — количество вещества, Δ T — изменение температуры.
- Раскройте физический смысл понятия «внутренняя энергия». Изменение внутренней энергии путем теплообмена. Запишите математическое выражение для количества теплоты при нагревании, плавлении, испарении.
Под внутренней энергией системы U в термодинамике понимают сумму кинетической энергии движения всех микрочастиц системы (атомов или молекул) и потенциальной энергии их взаимодействия между собой. Подчеркнем, что механическая энергия (потенциальная энергия тела, поднятого под поверхностью Земли и кинетическая энергия его движения как целого) не входит во внутреннюю энергию.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
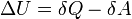
где
-
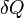 — подведённая к телу теплота, измеренная в джоулях
— подведённая к телу теплота, измеренная в джоулях -
 [1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
[1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
Второй способ изменения внутренней энергии системы (без совершения работы) называется теплообменом (теплопередачей). Количество энергии, полученное или отданное телом при таком процессе, называется количеством теплоты и обозначается ΔQ.
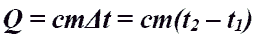 Количество теплоты при нагревании и охлаждении.
Количество теплоты при нагревании и охлаждении.
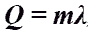 Количество теплоты при плавлении или кристаллизации.
Количество теплоты при плавлении или кристаллизации.
 Количество теплоты при кипении, испарении жидкости и конденсации пара.
Количество теплоты при кипении, испарении жидкости и конденсации пара.
- Сформулируйте и поясните первый закон термодинамики. Запишите его математическое выражение.
Термодина́мика — раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделилисьхимическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника.
В термодинамике имеют дело не с отдельными молекулами, а с макроскопическими телами, состоящими из огромного числа частиц. Эти тела называются термодинамическими системами. В термодинамике тепловые явления описываются макроскопическими величинами — давление, температура, объём, …, которые не применимы к отдельным молекулам и атомам.
В теоретической физике наряду с феноменологической термодинамикой, изучающей феноменологию тепловых процессов, выделяют термодинамику статистическую, которая была создана для механического обоснования термодинамики и была одним из первых разделов статистической физики.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 648; Нарушение авторских прав?; Мы поможем в написании вашей работы!