
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смеси, образующие простую эвтектику
|
|
|
|
Сплавы. Понятие о физико-химическом анализе. Термический анализ. Кривые охлаждения. Диаграмма состояния бинарной металлической системы с образованием эвтектики. Анализ диаграммы по правилу фаз Гиббса-Коновалова.
Диаграмма плавкости бинарной металлической системы с образованием химического соединения. Анализ диаграммы по правилу фаз Гиббса-Коновалова. Понятие об интерметаллидах. Правило фаз Гиббса-Коновалова.
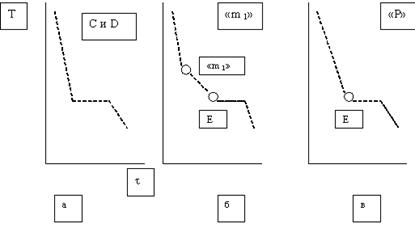
Сущность метода состоит в следующем. Берут вещество или смесь веществ и нагревают выше температуры плавления – получается гомогенная система. В жидкость погружают высокотемпературный термометр (или термопару), нагревание прекращают и через определенные промежутки времени фиксируют температуру. Строят график изменения температуры со временем, называемый кривой охлаждения.
Если это соединение термически устойчиво, то есть при плавлении не разлагается, то кривая его охлаждения подобна кривой охлаждения чистого вещества (рис. 2, а). Диаграмма состояния такой системы представлена на рис 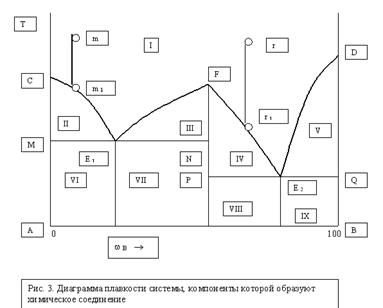 Точка F на диаграмме соответсвует температуре плавления химического соединения AmBn. Диаграмма состоит как бы из двух эвтектических диаграмм, подобных изображенной на рис. 1. Каждая из частей диаграммы имеет свою точку эвтектики. Точка E 1 отвечает эвтектической смеси, состоящей из кристаллов вещества А и химического соединения, а точка E 2 - эвтектической смеси химического соединения и компонента B. На диаграмме можно выделить следующие области:
Точка F на диаграмме соответсвует температуре плавления химического соединения AmBn. Диаграмма состоит как бы из двух эвтектических диаграмм, подобных изображенной на рис. 1. Каждая из частей диаграммы имеет свою точку эвтектики. Точка E 1 отвечает эвтектической смеси, состоящей из кристаллов вещества А и химического соединения, а точка E 2 - эвтектической смеси химического соединения и компонента B. На диаграмме можно выделить следующие области:
I – гомогенная система, содержащая оба компонента в жидкой фазе;
II – гетерогенная система, состоящая из кристаллов А и жидкого раствора обоих компонентов;
III, IV – гетерогенные системы, состоящие из кристаллов химического соединения и жидкого раствора;
V – гетерогенная система – кристаллы компонента В и раствор;
VI – твердая эвтектическая смесь, содержащая кристаллы А и химического соединения и избыток кристаллов А;
VII - твердая эвтектическая смесь AmBn с А и избыток кристаллов AmBn;
VIII - твердая эвтектическая смесь, содержащая кристаллы химического соединения и компонента В и избыток кристаллов химического соединения;IX – та же смесь и избыток кристаллов компонента В.При охлаждении жидкого раствора, состав которого определяется точкой m, при температуре, определяемой точкой m 1, начнется кристаллизация вещества А. Если же взять смесь r, то при понижении температуры до r 1 начнут выпадать кристаллы химического соединения.
Число степеней свободы в точке F равно нулю, так как для этой точки существует математическое уравнение, связывающее концентрации компонентов, а именно: на m моль А приходится n моль В, и число независимых компонентов равно 1. Тогда: с = 1 – 2 + 1 = 0. Таким образом, на данной диаграмме имеется 5 точек, соответсвующих нонвариантным системам: это точки C, D, E 1, E 2, F.
При благоприятных условиях в металлических системах образуются фазы с определённым стехиометрическим соотношением компонентов. Они получили название интерметаллических соединений
Состав таких соединений весьма разнообразен, но определяется он в основном указанными выше двумя причинами - размером атомов, характером и числом электронов в зоне проводимости. Например если радиус атома А в 1,26 раза больше радиуса атома В, то объём атома А будет в 2 раза больше, чем В. В этом случае в кристаллической решётке металла атом В займёт одно место, а атом А - два. Соотношение атомов будет АВ 2. Фазы, образующиеся по такому принципу, называются фазами Лавеса. Типичным примером такой фазы может служить соединение MgCu 2.
Твёрдые многокомпонентные металлические системы получили название сплавов.
Диаграммы состояния систем твердое тело – жидкость строят на основании результатов термического анализа. Сущность метода состоит в следующем. Берут вещество или смесь веществ и нагревают выше температуры плавления – получается гомогенная система. В жидкость погружают высокотемпературный термометр (или термопару), нагревание прекращают и через определенные промежутки времени фиксируют температуру. Строят график изменения температуры со временем, называемый кривой охлаждения.
Диаграммы такого типа встречаются при изучении равновесий в системах: олово – свинец, цинк – кадмий, бензол – нафталин, хлорид натрия – вода. В таких системах компоненты неограниченно растворимы друг в друге в жидком состоянии и совершенно не растворяются в твердом состоянии. Диаграмма такого типа изображена на рис. 1.
По оси абсцисс отложена массовая доля одного из компонентов В, по оси ординат – температура. Поскольку вещества находятся в конденсированном состоянии, давление на фазовые равновесия практически не влияет. Область на диаграмме, расположенная выше кривой СЕD, отвечает гомогенной жидкой системе. Точки С и D – это температуры кристаллизации (или плавления) чистых компонентов А и В. Если кчистому компоненту А добавить некоторое количество компонента В, то температура начала кристалллизации понизится. Мы знаем, что растворы начинают замерзать при более низкой температуре, чем чистый растворитель (следствие из закона Рауля). Линия СЕ называется линией ликвидуса (или линией жидкости). Точно так же, если взять чистый компонент В и прибавлять к нему компонент А, температура начала кристаллизации будет понижаться (кривая ДЕ). Точка пересечения кривых ликвидуса Е называется эвтектической точкой, а соответствующая смесь – эвтектической смесью или просто эвтектикой (слово «эвтектика» происходит от греческого «легкоплавкий»).
Таким образом, эвтектика представляет собой смесь веществ, имеющая минимальную температуру замерзания
Линия MN на диаграмме называется линией солидуса, то есть твердого тела. Ниже этой линии существуют только твердые фазы.
 |
Теперь возьмем надиаграмме точку n. Эта точка соответствует гетерогенной системе, состоящей из твердой и жидкой фаз. Для того, чтобы определить состав фаз, проведем через точку n горизонталь. Точка пересечения с линией ликвидуса n 1 покажет состав жидкой фазы. В точке n 2 горизонталь пересекается с осью ординат, отвечающей w В = 100 %. Следовательно, твердая фаза представляет чистый компонент В. Относительные количества твердой и жидкой фаз можно найти по правилу рычага:

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1519; Нарушение авторских прав?; Мы поможем в написании вашей работы!