
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантово-механическая модель строения атома
|
|
|
|
В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми
Принцип неопределённости Гейзенбе́рга (или Га́йзенберга) в квантовой механике — фундаментальное неравенство (соотношение неопределённостей), устанавливающее предел точности одновременного определения пары характеризующих систему квантовых наблюдаемых, описываемых некоммутирующими операторами (например, координаты и импульса, тока и напряжения, электрического и магнитного поля)
14. Ква́нтовое число́ в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы.
Некоторые квантовые числа связаны с движением в пространстве и характеризуют пространственное распределение волновой функции частицы. Это, например, радиальное (главное) (nr), орбитальное (l) и магнитное (m) квантовые числа электрона в атоме, которые определяются как число узлов радиальной волновой функции, значение орбитального углового момента и его проекция на заданную ось, соответственно.
15. Атомная орбиталь — одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома[1], задаётся главным n, орбитальным l и магнитным m квантовыми числами.
Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемым ядром атома со всеми остальными электронами атома.
16. В соответствии с принципом Паули электроны, находящиеся на одних и тех же атомных орбиталях и, следовательно, имеющие одинаковые значения трёх квантовых чисел (n, l и ml), обязательно должны отличаться величинами спина (ms = ± ½). Правило запрета ограничивает число мест для электронов на данном энергетическом уровне, поскольку, на одной орбитали могут находиться только 2 электрона. В противном случае все электроны заняли бы орбиталь с наименьшей энергией. Так, для n = 1 (минимум энергии), l = 0, ml = 0 и электроны могут отличаться друг от друга только спиновым квантовым числом: ms = + ½, ms = - ½. Третьему электрону запрещено находиться на уровне с указанным. Аналогично легко показать, что при n = 2 максимальное число электронов второго уровня равно 8, при n = 3 восемнадцать (18)
17. П р а в и л о К л е ч к о в с к о г о. Электроны заполняют энергетические подуровни в порядке увеличения их энергии. Этот порядок определяется значением суммы главного и побочного квантовых чисел (n + l): 1 s, 2 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, 4 f, 5 d, 6 p, 7 s, 5 f, 6 d.
18. П р а в и л о Г у н д а. На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома
19. Периодический закон Д. И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «…свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».[1] Графическим (табличным) выражением периодического закона является разработанная Менделеевым периодическая система элементов.
20. Периодичность изменения свойств элементов означает, таким образом, повторный возврат к тем же в основном признакам (к металлическим свойствам щелочных, щелочноземельных, земельных и других металлов, к неметаллическим свойствам элементов групп фосфора, серы и хлора), которые уже встречались в предыдущем периоде и повторяются на известной ступени, через определенное число элементов в последующих периодах в строго закономерной последовательности. Как уже было сказано выше, эта периодичность представляет собой конкретное проявление одного из основных законов диалектики - закона отрицания отрицания
21.
22. энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией (потенциалом) ионизации I:
Э + I = Э+ + е-
Энергия ионизации выражается в кДж/моль или эВ/моль. Энергии, необходимые для отрыва второго, третьего и последующих электронов, носят название второй (I2), третьей (I3) и т.д. энергий ионизации. Увеличение положительного заряда образовавшегося иона ведет к росту энергии ионизации (I1<I2< I3…).
Сродство к электрону. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (Е):
Э + е- = Э- - Е
Сродство к электрону выражается в кДж/моль или эВ/моль.
Для элементов главных подгрупп сродство к электрону возрастает в периодах слева направо и уменьшается в группах сверху вниз. Максимальное значение сродства к электрону имеет фтор.
Электроотрицательность. Способность атома, находясь в составе устойчивой молекулы, смещать к себе электронную плотность характеризуется электроотрицательностью. Существует много способов количественной оценки электроотрицательности. Так, электроотрицательность по Малликену (χ) равна полусумме энергии ионизации и сродства к электрону:
χ = ½ (I + Е)
Для s- и р-элементов электроотрицательность возрастает в периодах слева направо и уменьшается в группах сверху вниз. Минимальное значение сродства к электрону имеет франций, а максимальное – фтор.
23. Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Насыщаемость – определяет стехиометрию (количественный состав) молекулярных химических соединений.
Это свойство заключается в том, что каждый атом может присоединить только определенное число других атомов. Так, как правило, простые газообразные вещества состоят из 2 атомов: О2, Сl2, N2 и т.д.
2. Направленность – определяет пространственную структуру молекулы (форму молекулы). Направленность зависит: 1) – от числа атомов в молекуле; 2) – от типа взаимодействующих электронных облаков
24.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
25. Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электроноватома-донора и свободной орбитали атома-акцептора
Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару
26. Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
· Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.

Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
· Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
27. Электролитами называются вещества, распадающиеся на ионы в растворах и расплавах. Основная особенность растворов электролитов – они проводят электрический ток. Ионы, заряженные положительно, называются катионами, а отрицательно заряженные – анионами.
Электролитической диссоциацией называется процесс распада электролита на ионы под действием полярных молекул растворителя.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы
28. Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
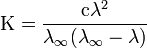
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства

где α — степень диссоциации.
29. Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды
Водоро́дный показа́тель, pH (лат. p ondus H ydrogenii - сила водорода, произносится «пэ аш», английское произношение — piː'eɪtʃ) — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водородав растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр
30.
Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов. 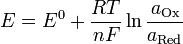 ,
,
где
31. Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
32. Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде
33. Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов.
34. Коллоидные системы, коллоиды (др.-греч. κόλλα — клей + εἶδος — вид; «клеевидные») — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями, в которых дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер хотя бы в одном из измерений от 1 до 100 нм, распределены в дисперсионной среде, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок.
Диспе́рсная систе́ма — это образования из двух или более числа фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
35. Полимеры - высокомолекулярные соединения (ВМС), с молекулярной массой от нескольких тысяч до многих миллионов. Молекулы полимеров состоят из большого числа повторяющихся звеньев. Олигомеры занимают промежуточное положение между низкомолекулярными соединениями и ВМС, молекулы их содержат 2 или несколько структурных звеньев.
В химии олигомер — молекула в виде цепочки из небольшого числа одинаковых составных звеньев. Этим олигомеры отличаются от полимеров, в которых число звеньев теоретически не ограничено.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 849; Нарушение авторских прав?; Мы поможем в написании вашей работы!