
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление химической реакции,энергия Гиббса
|
|
|
|
В механических системах устойчивое равновесие соотв-ет минимуму потенциальной энергии системы. Хим. процессы должны самопроизвольно протекать в направлении уменьшения внутренней энергии системы, т. е. в направлении, отвечающем положит-му тепловому эффекту реакции. При обычных усл. самопроизвольно протекают преимущ-но экзотермические реакции. Так же, уже при обычных t-рах самопр-но протекают эндотермические процессы растворения мн. солей и некоторые эндотерм. хим. р-ции. С повыш. t-ры все большее число реакций начинает самопр-но протекать в направ. эндотерм. процесса. Принцип стремления к минимуму внутренней энергии требует, чтобы все экзотерм. р-ции доходили до конца, т. е. исключает возможность обратимых реакций; однако такие реакции сущ-ют. Среди мех-ких систем имеются такие, поведение которых тоже нельзя описать только направленностью процессов к достижению минимума потенциальной энергии. Из громадного числа частиц состоят и хим. системы. Тенденция к достижению минимума внутр. энергии не явл. единств. фактором, определяющим их поведение. Для представления о 2-м факторе, влияющем на на-правление р-ций, рассм. процесс, не сопровождающийся тепловым эффектом. Н-р, расширение разряж-го газа. С ростом числа молекул вер-сть беспоряд-го, равно-мерного распред-ния газа в сосуде очень быстро возрас-тает, а самопроиз-ное сжатие газа становится все менее вероятным процессом. Макроскоп. кол-ва газа содержат огромное число молекул, соотв-но в реальном опыте самопр-ное сжатие газа предст. собой процесс практически невозможный, и что самопр-но будет протекать обратный процесс расширения газа, приводящий к равномерному, беспорядоч. распред-ю его молекул по всему объему сосуда.
Направление самопроизвольного протекания химиче-ских реакций и определяется совокупным действием двух факторов: тенденцией к переходу системы в состояние с наименьшей внутренней энергией и тенденцией к достижению наиболее вероятного состояния.
При хим. реакциях в силу принципа направл-ти процес-сов к минимуму внутренней энергии атомы соединяются в такие молекулы, при образовании которых выделяется наиб. кол-во энергии. В силу же принципа направленно-сти процессов к наиболее вероятному состоянию проте-кают такие реакции, в ходе которых возрастает число частиц (н-р, р-ции разложения молекул на атомы) или чисто возможных состояний атомов. Тенденция к переходу в состояние с наименьшей внут-ренней энергией проявляется при всех температурах в одинаковой степени. Тенденция же к достижению наиболее вероятного состояния проявляется тем сильнее, чем выше температура. Поэтому при низких температурах в большинстве случаев практически сказывается только влияние первой из этих тенденций, в результате чего самопроизвольно протекают экзотермические процессы. По мере возрастания температуры равновесие в химических системах все больше и больше сдвигается в сторону реакций разложения или увеличения числа состояний атомов. При этом каждой температуре отвечает состояние равновесия, характеризующееся определенным соотношением концентраций реагирующих веществ и продуктов реакции.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
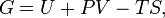
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Классическим определением энергии Гиббса является выражение
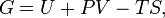
где  — внутренняя энергия,
— внутренняя энергия, 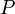 — давление,
— давление, 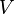 — объём,
— объём, 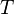 — абсолютная температура,
— абсолютная температура, 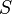 — энтропия.
— энтропия.
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — черездавление p и температуру T:
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 686; Нарушение авторских прав?; Мы поможем в написании вашей работы!