
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условия, влияющие на скорость химических реакций
|
|
|
|
Факторы влияющие на скорость хим.реакции.закон действия масс.правила ван- гофа
Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) — сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt. Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т.е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени:
1) Скорость реакции зависит от природы реагирующих веществ. Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры. Например, для горения топлива необходимо его поджечь, т.е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ. Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1)! Формула (2) выражает скорость на единице площади, следовательно не может зависеть от площади.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.
Закон действия масс: отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ, все концентрации в степенях, равных их стехиометрическим коэффициентам, есть постоянная, называемая константой равновесия.
Для mA + nB  pC + qD имеем: K =
pC + qD имеем: K = 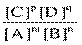
Для N2 + 3H2  2NH3 имеем: K =
2NH3 имеем: K = 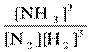
Константа равновесия - это количественная мера прямой реакции данного уравнения.
К=0 - прямая реакция не идет;
К= 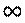 - прямая реакция идет до конца.
- прямая реакция идет до конца.
К>1 - равновесие сдвинуто вправо;
К<1 - равновесие сдвинуто влево.
G для этой же реакции:DКонстанта равновесия реакции К связана с величиной изменения стандартной энергии Гиббса
G = -2,3RTlgK или К = 10DG = -RTlnK или D-0,435 DG /RT
Если К>1, то lgK>G D0 и <0, то есть, если равновесие сдвинуто вправо, то реакция - переход от исходного состояния к равновесному - идет самопроизвольно.
Если К<1, то lgK<G D0 и >0, то есть, если равновесие сдвинуто влево, то реакция самопроизвольно вправо не идет.
ПравилоВант-Гоффа - при повышении температуры на 10° С скорость реакции увеличивается в 2-4 раза.
Это правило является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакций, протекающих при температурах, близких к комнатной (энергия активации таких реакций 50-150 кДж/моль).
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2753; Нарушение авторских прав?; Мы поможем в написании вашей работы!