
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Нернста
|
|
|
|
Электрохимическое поведение металлов в водных растворах.
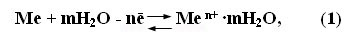
По своему поведению при электролизе водных растворов все металлы можно разделить на три группы:
1)активные металлы Li→Mn – никогда не выделяются на катоде из-за высокой восстановительной способности, вместо них выделяется Н2.
2)металлы – средней активности, Mn→H2 могут выделяться на катоде вместе с водородом.
3)Малоактивные металлы Н2→ выделяются на катоде в первую очередь, водород не выделяется.
Аноды: Инертные – не участвующие в процессе электролиза. Анод называется активным или растворимым если он участвует в процессе электролиза.
Электролиз K2SO4
К(-) : 2 H2O + 2e ---> H2 + 2 0H-
А(+): 2 H2O - 4e ---> 4 H+ + O2
Электролиз Cu(NO3)2
а) Графитовый анод
А(+): 2 H2O - 4e ---> 4 H+ + O2 | 1 | - окисление E0(H2O/O2) = 1,23 В
К(-): Сu2+ + 2e ---> Cu0 | 2 | - восстановление E0(Cu2+/Cu) = 0,34 В
--------------------------------------
2 Cu2+ + 2 H2O --эл. ток--> 2 Cu + 4 H+ + O2
--------------------------------------
2 Cu(NO3)2 + 2 H2O --эл. ток--> 2 Cu + 4 HNO3 + O2
По закону Фарадея определим массу выделившегося кислорода и меди на электродах:
m(O2) = I * t * Mэ(O2) / F = 6 * 7200 * (32/4) / 96500 = 3,58 г
m(Cu) = I * t * Mэ(Сu) / F = 6 * 7200 * (64/2) / 96500 = 14,33 г
б) Медный анод
А(+)/Сu: Cu0 - 2e ---> Сu2+ | 1 | - окисление
К(-): Сu2+ + 2e ---> Cu0 | 1 | - восстановление
----------------------------------------
Cu0 + Сu2+ --эл. ток--> Сu2+ + Cu0
----------------------------------------
Cu0 + Cu(NO3)2 --эл. ток--> Cu(NO3)2 + Cu0
Т.о. медь с анод переходит на катод.
По закону Фарадея определим массу выделившегося меди на катоде:
m(Cu) = I * t * Mэ(Сu) / F = 6 * 7200 * (64/2) / 96500 = 14,33 г
№29.
Ряд стандартных электродных потенциалов характеризует химическое поведение металлов и их солей в водных растворах при температуре 298,15 К; зависимость же значений электродных потенциалов от концентрации ионов в растворе и температуры определяется уравнением Нернста: 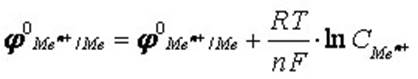
где R – универсальная газовая постоянная, равная 8,314 Дж/(моль·К);
Т - термодинамическая температура, К;
n - заряд иона;
F – постоянная Фарадея, равная 96485 Кл/моль;
CMen+ - молярная концентрация ионов в растворе, моль/л
При подстановке числовых значений универсальной газовой постоянной и постоянной Фарадея и при переходе к десятичным логарифмам, при температуре 298,15 К уравнение электродного потенциала принимает вид: 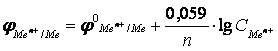
Электродвижущая сила гальванического элемента (ЭДС) — скалярная физическая величина, характеризующая работу сторонних (непотенциальных) сил в источниках постоянного или переменного тока. В замкнутом проводящем контуре ЭДС равна работе этих сил по перемещению единичного положительного заряда вдоль контура. Зависит от материала электродов и состава электролита. ЭДС так же, как и напряжение, измеряется в вольтах. Можно говорить об электродвижущей силе на любом участке цепи. Это удельная работа сторонних сил не во всем контуре, а только на данном участке. ЭДС гальванического элемента есть работа сторонних сил при перемещении единичного положительного заряда внутри элемента от одного полюса к другому. Работа сторонних сил не может быть выражена через разность потенциалов, так как сторонние силы непотенциальны и их работа зависит от формы траектории. Так, например, работа сторонних сил при перемещении заряда между клеммами тока вне самого источника равна нулю. Сейчас широко распространены следующие гальванические элементы.
угольно-цинковые (солевые) 1,5 дешёвые
щелочные (алкалиновые) 1,6 высокий ток, ёмкие
никельоксигидроксидные (NiOOH) 1,6 высокий ток, очень ёмкие
литиевые 3,0 очень высокий ток, очень ёмкие
Электролиз – совокупность процессов, протекающих при пропускании постоянного электрического тока через электрохимическую систему, состоящую из 2 электродов и раствора или расплава электролиза.
Законы электролиза:
1)масса вещества, выделяющаяся на электроде, пропорциональна количеству электричества, пропущенного через раствор или раствор электролита.
2)при электролизе различных химических соединений равное количество электричества приводит к электрохимическому превращению эквивалентных количеств вещества.
m=(MэJt)/F
Число Фарадея -постоянная (F), одна из фундаментальных физических постоянных, равная произведению Авогадро числа Nа на элементарный электрический заряд е (заряд электрона):
F = Nа*е = (9,648456 ± 0,000027) (104 к моль-1.
Выход по току - это масса вещества, образованного в результате электролиза при пропускании через раствор тока определенной силы(I) в течение определенного времени (t). Рассчитывается с помощью закона Фарадея по формуле:
m = (Мэ*I*t)/F, где Мэ - эквивалентная масса вещества, равная отношению его молярной массы к количеству принятых (или отданных) электронов;
F = 96500 Кл – число Фарадея (т.е. расчет не по другим веществам - участникам реакции (реагентам или продуктам), а по значениям силы тока и времени электролиза).
Практический выход по току обычно меньше 100% (если в долях единицы - меньше 1), т.к. на практике, в реальных условиях, обязательно будут потери вещества. В таком случае выход по току равен отношению практической массы продукта электролиза к теоретической, рассчитанной по закону Фарадея; для выражения выхода в процентах результат нужно умножить на 100%. Выход продукта реакции обозначается греческой буквой "эта".
№30.
Реакции окисления на аноде также имеют свои особенности. Различают электролиз с растворимыми (активными) и нерастворимыми (инертными) металлическими анодами.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 572; Нарушение авторских прав?; Мы поможем в написании вашей работы!