
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
E. Цистеїн, пролін
|
|
|
|
462. При гідролізі яких біополімерів утворюються L-амінокислоти?
*A. Білків;
B. Нуклеїнових кислот;
C. Глікогену;
D. Крохмалю;
E. Гіалуронової кислоти.
463. α, β і γ-Амінокислоти по різному відносяться до нагрівання. При нагріванні якої з приведених кислот утворюється акрилова кислота (СН2=СН-СООН)?
A. 
B. 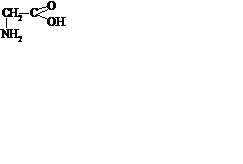
C. 
D. 
*E. 
464. Для кількісного визначення α‑амінокислот використовується реакція дезамінування з наступним виміром об’єму азоту, що виділився. За участю якого реагенту проводять цю реакцію?
*A. HNO2;
B. NaCl;
C. KOH;
D. NH4NO3;
E. HCl.
465. Виберіть амінокислоту, яка утворюється в результаті трансамінування наведеної кислоти:
*A. Аланин;B. Аргинин;C. Глутаминовая кислота;D. Аспарагиновая кислота;E. Глицин.
466. Виберіть сірковмісні амінокислоти:
A. Аргинин;
*B. Метіонін;
C. Серин;
D. Триптофан;
E. Треонін.
467. Пептидні зв’язки утворюються між групами:
*A. NH2 i COOH;
B. NH2 i CH3;
C. NH2 i SH;
D. СООН і ОН;
E. СООН і СН3.
468. Всі α-амінокислоти дають позитивну реакцію:
A. Фоля.
B. Біуретову;
*C. Нінгідринову;
D. Ксантопротеїнову;E. Адамкевича.
469. a,b і g-амінокислоти по різному відносяться до нагрівання. Яка сполука утворюється при нагріванні g–аміномасляної кислоти: 
A. 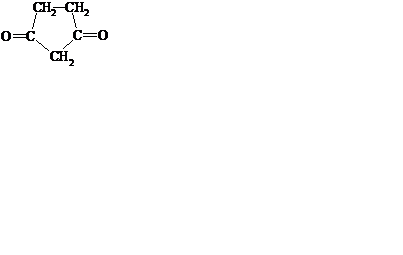
B. 
C. 
*D. 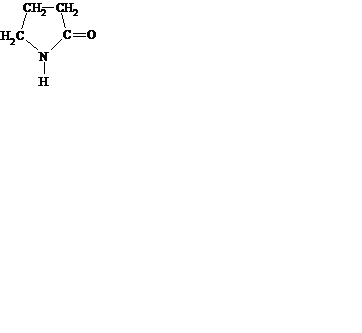
E. CH2═CH─CH2─COOH.
470. Виберіть кольорові реакції, які дозволяють виявити ароматичні цикли амінокислот в молекулах білків.A. Біуретова;B. Нінгідринова;*C. Ксантопротеїнова;D. Фоля;E. Лоурі.
471. Біогенні амінокислоти добре розчинні у воді і мають як для органічних сполук аномально високі температури топлення. Що є причиною таких особливих фізичних властивостей цього класу органічних речовин?
*A. Здатність амінокислоти утворювати біполярний йон;
B. Наявність карбоксильної групи;
C. Наявність аміногрупи з вільною парою електронів;
D. Наявність різних радикалів при вуглеці;
E. Наявність двох функціональних груп.
472. Виберіть дикарбонову амінокислоту.
A. Ізолейцин;
*B. Аспарагінова кислота;
C. Лізин;
D. Аргінін;
E. Лейцин;
473. Яка з нижченаведених сполук є продуктом не окисного дезамінування a-амінокислоти:

A.

B.C. R – CHCl - CHCl– COOH*D. R – CH2 – COOH

E.
474. При нагріванні 3-амінопропанова кислоти перетворюється в акрилову кислоту

Визначте тип реакції, що має місце в даному випадку:
A. Приєднання;
B. Заміщення;
*C. Елімінування;
D. Перегрупування;
E. Відновлення.
475. Досліджуваний розчин дає позитивні реакції біуретову і ксантопротеїнову. Які ймовірні компоненти даного розчину?
A. Імінокислоти і цистеїн;
B. Білок і глюкоза;
C. Пролін і аланін;
*D. Білок або поліпептид, до складу якого входять ароматичні амінокислоти;
E. Мальтоза і глутамінова кислоти.
476. При описанні будови пептидної групи R1–[С(О)–NH]–R2 визначте невірний пункт:
A. вільне обертання можливе навколо зв’язків С–Сα та N–Cα, але воно частково обмежене і залежить від розмірів, полярності та інших властивостей радикалу.
B. орбіталь, що утворена неподіленою парою електронів атому N входить в спряження з π-зв’язком групи С=О. Тому зв’язок С-N в пептидній групі коротший ніж такий в амінах.
C. осьове обертання навколо C–N зв’язку обмежене.
D. в спряженій системі електронна густина зміщена до атома кисню.
*E. атоми C і N, О та H, лежать в одній площині і знаходяться в стані sp3 гібридизації.
477. Котрі з перерахованих амінокислот відносяться до лужних:
A. Триптофан, аргінін;
B. Фенілаланін, тирозин;
*C. Аргінін, лізин, гістидин;
D. Лейцин, гліцин;
E. Аспарагінова та глютамінова кислоти.
478. В аналітичній практиці застосовують реакцію дезамінування a-амінокислот під дією азотистої кислоти. Яка сполука утворюється внаслідок дезамінування аланіну?
A. Пропенова кислота;
B. Піровиноградна кислота;
C. Гліколева кислота;
D. Пропанова кислота;
*E. Молочна кислота.
479. Яка з наведених реакцій приводить до утворення пептидного зв’язку:
A. 
B. 
C. 
*D. 
E. 
480. Нінгідриновий реактив використовують для якісного визначення:
A. Глюкози;
*B. a-Амінокислот;
C. Нуклеїнових кислот;
D. Азотистих основ;
E. Імінокислот.
481. До складу білка входять протеїногенні амінокислоти. У якому положенні в їх структурі обов’язково повинна бути аміногрупа?
A. d-положенні;
B. b-положенні;
C. g-положенні;
*D. a-положенні;
E. e-положенні.
482. Які з нижче перерахованих амінокислот є кислими?
A. Тирозин, фенілаланін;
*B. Аспарагінова і глютамінова амінокислоти;
C. Аспарагінова кислота і гліцин;
D. Глютамінова кислота і гліцин;
E. Метіонін, триптофан.
483. Яка з нижченаведених сполук є продуктом окисного дезамінування амінокислоти:
A. R-CH=CH-COOHB.C. R-CH2-COOHD. R – CH=N–COOH

*E.
484. Визначте які амінокислоти, входять до складу наведеного дипептиду:

*A. Глутамінова кислота і метіонін;
B. Глутамінова кислота і аланін;
C. Глутамін і метіонін;
D. Метіонін і аспарагін;
E..Глутамінова кислота і глютамін.
485. Дисульфідний зв’язок виникає між амінокислотами:
А. Цистеїнoм і лізином.
В. Аргініном і глютаміновою кислотою.
*С. Залишками цистеїну.
D. Аргініном і цистеїном.
Е. Метіоніном і цистеїном.
486. Визначте які амінокислоти, входять до складу наведеного трипептиду:

А. Цистеїн і лізин, аспарагін.
В. Аргінінін і глютамінова кислота, лізин.
С. Залишки цистеїну.
D. Аргінін і цистеїн, гістидин.
*Е. Метіонін, аланін, триптофан.
487. Три пептид має назву:

Фенілаланін-триптофан-серин;
Аланін-гліцин-триптофан;
Ізолейцин-гліцин-аланіл;
*Терозил-ізолейцил-гліцин;
Гліцил-терозил-ізолейцин.
488. Визначте які амінокислоти, входять до складу наведеного диипептиду:

*А. Валін і гліцин.
В. Аргінінін і лізин.
С. Залишки цистеїну.
D. Аргінін і цистеїн, гістидин.
Е. Аланіні валін.
489. Скільки амінокислотних залишків містить пептид?

А. 6.
В. 8.
С. 9.
D. 4.
*Е. 5

490. Скільки амінокислотний залишків містить пептид?
*А. 6.
В. 8.
С. 9.
D. 4.
Е. 5
491. Які амінокислотні залишки утворюють цей пептид?

А. Валін, аланін, тирозин, треонін, два метіоніну.
В. Лейцин, триптофан, два метіонін, гліцин, тирозин, цистеїн.
С. Гістидин, фенілаланін, глютамінова кислота, цистин.
*D. Триптофан, два метіоніну, гліцин, тирозин, цистеїн.
Е. Фенілаланін, два метіоніну, гліцин, тирозин, цистеїн.
492. Ця сполука є:

А. Дипептидом.
В. Пентапептидом.
С. Тетрапептидом.
*D. Трипептидом.
Е. Декапептидом.
493.Визначте які амінокислоти, входять до складу наведеного дипептиду:

A. Аргінін і аланін;
B. Гліцин і серин;
C. Серин і аланін;
D. Валін і гліцин;
*E. Аргінін і серин.
494. Визначте які амінокислоти, входять до складу наведеного дипептиду:

A. Аргінін і аспарагін
B. Серин цистеїн
*C. Цистеїн і аспарагін
D. Серин і аспарагін
E. Валін і цистеїн
495. Визначте які амінокислоти, входять до складу наведеного дипептиду:

A. Серин і аланін;
B. Аланін і валін;
C. Гліцин і глутамінова кислота;
*D. Гліцин і аланін;
Валін і гліцин.
496. Визначте які амінокислоти, входять до складу наведеного дипептиду:

A. Аргінін і аспарагін;
B. Серин цистеїн;
C. Глутамін і аспарагін;
D. Серин і аспарагін;
*E. Серин і глютамін.
497. Визначте які амінокислоти, входять до складу наведеного дипептиду:

*A. Аспарагінова кислота і аланін;
B. Глутамін і аланін;
C. Серин і аспарагін;
D. Глутамінова кислота і глютамін;
E. Глутамінова кислота і аспарагін.
498. Для амінокислот характерними є такі хімічні властивості: 1) можлива реакція з хлоридною кислотою; 2) можлива взаємодія з натрій гідроксидом; 3) можлива реакція з активними металами; 4) реагують зі спиртами; 5) амінокислоти не горять. Яке з цих тверджень є помилковим відносно амінокислот?
*А. 5
В. 1
С. 3
D. 4
Е. 2
Білки
499..Сумарний позитивний заряд мають білки, в яких переважають:
*А. Лізин і аргінін
В. Аспарагінова і глютамінова кислоти
С. Лізин і глютамінова кислота
Д. Метіонін і тирозин
Е. Лізин і аспарагінова кислота
500. Вміст білка в сироватці крові пацієнта С визначили рефрактометричним методом, який ґрунтується на властивості білка:
*А. Заломлювати промінь світла.
В. Розсіювати промінь світла у вигляді конуса.
С. Повертати площину поляризованого променя.
Д. Створювати онкотичний тиск.
Е. Не проходити через напівпроникну мембрану.
501. Сумарний негативний заряд мають білки, в яких переважають:
*А. Аспарагінова і глутамінова кислоти.
В. Лізин і глутамінова кислота.
С. Лізин і аргінін.
Д. Метіонін і тирозин.
Е. Лізин і аспарагінова кислота.
502. Глікопротеїни складаються з білка та:
*А. Вуглеводних компонентів.
В. Цереброзидів.
С. Неорганічного фосфору.
Д. Забарвлених речовин.
Е. Нуклеотидів.
503. Які прості білки входять до складу нуклеопротеїнів?
*А. Протаміни, пістони.
В. Фібриноген, колаген.
С. Альбуміни, глобуліни.
Д. Проламіни, глютеліни.
Е. Протеїноїди, цереброзиди.
504. В групу хромопротеїнів входять наступні речовини, крім:
А. Гемоглобін;
*В. Муцин;
С. Міоглобін;
Д. Цитохроми;
Е. Катала за.
505. До складу рибонуклеопротеїнів входять перераховані речовини за виключенням:
А. Амінокислоти;
В. Урацил;
*С. Тимін;
Д. Рибоза;
Е. Фосфорна кислота.
506. До складу фосфопротеїнів входять:
А. Амінокислоти, пентози, неорганічний фосфор;
В. Пуринові та піримідинові основи;
*С. Простий білок і фосфор неорганічний;
Д. Нуклеотиди та фосфор неорганічний;
Е. Неорганічний фосфор та глюкоза.
507. Прості білки - це сполуки:
А. Молекули яких складаються з амінокислот і азотистих основ;
В. Молекули яких містять метали;
*С. Молекули яких при гідролізі розпадаються лише на амінокислоти;
Д. Молекули яких містять залишок фосфорної кислоти;
Е. Молекули яких складаються з 10-ти амінокислот.
508. Вибрати вірну відповідь. Білки це:
A. Органічні сполуки, похідні вуглеводнів, що мають у своєму складі карбоксильну групу;
*B. Біоорганічні високомолекулярні сполуки, складної будови, побудовані із залишків α-L-амінокислот, що сполучені амідними (пептидними) зв’язками;
C. Сполуки, що мають циклічну будову молекули
D. Сполуки, до яких входять кілька гідроксильних груп
E. Похідні ароматичних вуглеводнів
509. Первинна структура білка підтримується за рахунок...... зв’язків
A. Складноефірних;
B. Іонних;
*C. Пептидних;
D. Водневих;
E. Гідрофобних.
510. При денатурації відбувається руйнування зв’язків в молекулі білка, за винятком:
A. Водневих
B. Іонних
*C. Пептидних.
D. Гідрофобних
E. Сил Ван-дер-Вальса
511. Висолювання – це зворотнє осадження білків з розчину під дією:
A. Солей важких металів
B. Концентрованих мінеральних кислот
*C. Насичених та напівнасичених солей лужних та лужноземельних металів.
D. Алкалоїдів
E. Високої температури
512. Вибрати основні типи впорядкованості вторинної структури природних білків:
A. γ і α – спіраль;
*B. α – спіраль і β структура;
C. ∆ - і α – спіраль;
D. γ і ∆ - спіраль;
E. β і γ структури.
513. Із поданих варіантів виберіть групу в якій є лише глікопротеїни:
*Муцин, казеїноген;
Гемоглобі, меозин;
Церулоплазмін, каталаза;
Цитохром, білірубін;
Гістони, білівердин.
515. Вибрати вірну відповідь. Пептиди це:
Органічні сполуки, похідні вуглеводнів, що мають у своєму складі карбоксильну групу
Біоорганічні високомолекулярні сполуки, складної будови, побудовані із залишків α-L-амінокислот, що сполучені амідними (пептидними) зв’язками;
Сполуки, що мають циклічну будову молекули
*Біомолекули, що відрізняються від власне білків меншою молекулярною масою та фізико-хімічними характеристиками;
Похідні ароматичних вуглеводнів.
516. Осадження білків за допомогою концентрованої азотної чи сульфосаліцилової кислот застосовують в медицині з метою:
*Визначення білка в сечі
Розподілу амінокислот
Визначення білка в крові
Очищення білка від низькомолекулярних домішок
Отримання однорідної білкової фракції
517. До складу поліпептидного ланцюга білка входять:
β-D-амінокислоти;
γ-L-амінокислоти;
γ-D-амінокислоти;
β-D-амінокислоти;
*α-L-амінокислоти.
518 Ізоелектрична точка білка це:
Значення рН середовища, в якому сумарний електричний заряд білкової молекули = 0.
Значення рН середовища, в якому сумарний електричний заряд білкової молекули = 1.
Значення рН середовища, в якому сумарний електричний заряд білкової молекули = 2.
Значення рН середовища, в якому сумарний електричний заряд білкової молекули = 1.5.
Значення рН середовища, в якому сумарний електричний заряд білкової молекули = 10.
519. В ізоелектричній точці…..
А. Білок стає найбільш іонізованим;
*В. Білок є електронейтральним;
С. Молекула білка набуває позитивного заряду;
D. Розчинність білка найбільша;
Е. Білок рухливий в електричному полі.
520. Каталітична функція білків полягає у тому, що
Білки здійснюють імунний захист;
Білки скорочують м’язи;
Білки здійснюють міжклітинний транспорт біомолекул;
*Всі ферменти являються за своєю хімічною природою білками або комплексами білків з небілковими сполуками;
Білки входять до структури біомембран, складають основу цитоскелету.
521. Денатурація білків - це:
Втрата білками гідрофобних властивостей і набуття гідрофільних.
*Повна втрата білками нативних властивостей з порушенням їх структури.
Осадження солями лужних та лужноземельних металів.
Здатність до діалізу.
Здатність білків утворювати гелі.
522. Лікар призначив пацієнту аналіз білкових фракцій крові. В лабораторії був використаний метод електрофорезу. Яка властивість білків дає змогу застосовувати даний метод?
Здатність до набухання
Оптична активність
Високий онкотичний тиск
*Наявність електричного заряду
Висока в’язкість
523. Кислотні властивості білків зумовлені наявністю в молекулі білка:
Лужних амінокислот;
Гідрофобних амінокислот;
Гістонів – ядерних білків;
*Кислих амінокислот;
Нейтральних амінокислот.
524. Класифікація білків за походженням:
Білки плазми крові, печінки;
*Людські, мікробні, тваринні білки;
Глобулярні, фібрилярні білки;
Кислі, основні білки;
Альбуміни, глобуліни, гістони.
525. З біологічної рідини шляхом висолювання виділили білок, який буде використаний для лікування. Яким методом можна звільнити його від низькомолекулярних домішок?
Секвенацією
Денатурацією
Висолюванням
Електрофорезом
*Діалізом
526. Захисна функція розчинів білків від коагуляції електролітами полягає у тому, що:
Біли втрачають гідрофобні властивості і набувають гідрофільних.
Білки здатні втрачати нативні властивості з порушенням їх структури.
Білки здатні осаджюватися солями лужних та лужноземельних металів.
Білки здатні до діалізу.
*Білки здатні утворювати розчини і адсорбуватися на частинках гідрофобних золів.
527. Що є основою виконання білком специфічних біологічних функцій:
Наявність NH2 групи;
Наявність подвійного зв’язку;
*Наявність просторової організації білка;
Наявність водневих зв’язків;
Наявність пептидних зв’язків.
528. Лужні властивості білків зумовлені наявністю в молекулі білка:
Кислих амінокислот;
Нейтральних амінокислот;
Пепсину;
*Лужних амінокислот;
Ароматичних амінокислот.
529. Класифікація білків за наявністю заряду та кислотності:
Білки плазми крові, печінки;
Людські, мікробні, тваринні;
Глобулярні, фібрилярні;
*Кислі, основні;
Альбуміни, глобуліни, гістони.
530. Для білків характерні властивості:
Низька молекулярна маса;
Не кристалізуються;
*Амфотерність;
Проходять через напівпроникні мембрани;
Висолювання солями важких металів.
531. Молекулярна маса білків коливається в межах:
1 – 500 Да;
500 – 1000 Да;
1000 – 5000 Да;
500 - 10000 Да;
*5000 - кілька мільйонів Да.
532. Молекулярна маса білків складає (Да:
*Від кількох тисяч до кількох мільйонів;
Від 100 – 300;
До 1000;
До 80;
Менше 1.
533. Білки за будовою поділяються:
*Глобулярні і фібрилярні;
Циклічні і ациклічні;
Ароматичні, насичені і ненасичені;
Важко і легкорозчинні;
Кислі і основні.
534. Структурна функція білків полягає у тому, що:
Білки здійснюють імунний захист;
Білки скорочують м’язи;
Білки здійснюють міжклітинний транспорт біомолекул;
Всі ферменти являються за своєю хімічною природою білками або комплексами білків з небілковими сполуками;
*Білки входять до структури біомембран, складають основу цитоскелету.
535. Молекули, які беруть участь у адгезії, тобто забезпечують фізичний контакт між клітинами, за хімічною природою є:
А. Хромопротеїнами;
*В. Протеогліканами;
С. Ліпопротеїнами;
D. Фосфопротеїнами;
Е. Фосфоліпідами.
536. Гідролізат виділеного з молока білка дає позитивні реакції: біуретову і з молібденовокислим амонієм. Який був виділений білок?
*А. Фосфопротеїн;
В. Металопротеїн;
С. Нуклеопротеїн;
D. Гліпопротеїн;
Е. Ліпопротеїн.
537. До складних білків належать:
А. Альбуміни, глобуліни, ліпопротеїни;
В. Протаміни, фосфатиди, хромопротеїни;
С. Гліцерофосфатиди, протеїнази, актоміозин;
D. Фібрин, металопротеїни, гангліозиди;
*Е. Нуклео-, фосфо-, ліпо-, гліко-, хромопротеїни.
537. Глікопротеїни складаються з білка та:
А. Цереброзидів;
*В. Вуглеводних компонентів;
С. Неорганічного фосфору;
D. Забарвлених речовин;
Е. Нуклеотидів.
539. Казеїноген - це білок класу:
А. Глікопротеїнів;
В. Хромопротеїнів;
*С. Фосфопротеїнів;
D. Нуклеопротеїнів;
Е. Ліпопротеїнів.
540. Нуклеопротеїни складаються з:
А. Нуклеозидів та простих білків;
*В. Нуклеїнових кислот та протамінів або гістонів;
С. Протамінів або гістонів та нуклеозидів;
D. Альбумінів і гістонів та пуринових основ;
Е. Простих білків та піримідинових основ.
541. Четвертинну структуру білка визначають методом:
А. Спектрополяриметрії;
В. Секвенації;
*С. Рентгеноструктурного аналізу;
D. Ультрацентрифугування;
Е. Іонообмінної хроматографії.
542. Гемоглобін - це білок:
А. Первинної структури;
В. Вторинної;
С. Третинної;
*D. Четвертинної;
Е. Пентапептид.
543. Вторину структуру білка визначають методом:
*А. Спектрополяриметрії;
В. Секвенації;
С. Рентгеноструктурного аналізу;
Д. Ультрацентрифугування;
Е. Іонообмінної хроматографії.
544. Методом Едмана можна визначити... структуру:
*А. Первинної структури;
В. Вторинної;
С. Третинної;
D. Четвертинної;
Е. Пентапептид.
545. У розчині змінилося рН. Які зв’язки руйнуються в структурі молекули білка?
А. Ковалентні;
В. Пептидні;
*С. Гідрофобні;
D. Дисульфідні;
Е. Водневі.
546. Методом спектрополяриметрії можна визначати білки, що мають структуру:
А. Первинну;
*В. Вторинну;
С. Третинну;
D. Четвертинну;
Е. Трипептиди;
547. В процесі гідролізу білка:
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2746; Нарушение авторских прав?; Мы поможем в написании вашей работы!