
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазові рівноваги. Речовини, що входять до термодинамічної системи, можуть знаходитись у різних агрегатних станах: твердому
|
|
|
|
Розділ 2
Речовини, що входять до термодинамічної системи, можуть знаходитись у різних агрегатних станах: твердому, рідкому і газоподібному, утворюючи одну або декілька фаз. Фазою називають однорідну в всіх точках за хімічним складом і фізичними властивостями частину системи, яка відділена від інших частин межею (поверхнею) поділу. Будь-яка система, що містить більше однієї фази, є гетерогенною, а рівновага, що встановилася у такій системі, називається фазовою або гетерогенною. Фазова рівновага характеризується рівністю хімічних потенціалів µі кожного компонента в усіх фазах при сталих р і Т. Основним законом, який описує гетерогенні системи, що знаходяться у стані рівноваги, є закон рівноваги фаз (правило фаз Гіббса):
С=К – Ф + n,
де С – число ступенів (параметрів) вільності; К– число компонентів; Ф – число фаз; n – число зовнішніх факторів, що впливають на стан системи.
Число ступенів вільності рівноважної гетерогенної системи, на яку впливають температура та тиск, дорівнює числу компонентів системи мінус число фаз плюс два.
С = К – Ф + 2.
Якщо розглядаються фазові рівноваги, які складаються з нелетких компонентів, або в яких можна знехтувати газоподібною фазою (такі системи називають конденсованими), то впливом тиску на фазову рівновагу можна знехтувати і тоді рівняння Гіббса набуває вигляду:
С = К – Ф + 1.
Правило фаз показує, яке число незалежних змінних (температура, тиск, концентрація) можна змінити, щоб не порушити рівноважний стан системи. Наприклад, для однокомпонентної системи, при числі фаз, рівному трьом, число ступенів вільності дорівнює нулю. Це означає, що жодного параметра стану системи не можна змінити, інакше порушиться стан рівноваги.
Число ступенів вільності не може мати від’ємного значення і за значенням його термодинамічні системи поділяються на:
· нонваріантні (С = 0);
· моноваріантні (С = 1);
· біваріантні (С = 2);
· багатоваріантні (С = 3, 4, 5,...).
Для вивчення фазових рівноваг використовують метод фізико-хімічного аналізу, сутність якого полягає у встановленні залежності будь-якої фізичної властивості системи від її складу. Як властивості можуть служити теплові, електричні, оптичні та ін. Графічним відображенням цієї залежності є діаграми стану (фазові діаграми), побудовані в координатах властивість – склад. Для цього застосовують методи розчинності, термічного аналізу, рентгено-, електроно-, нейтронографії та ін. За допомогою аналізу діаграм стану встановлюють області співіснування й склади рівноважних фаз, з'ясовують характер взаємодії компонентів, наявність сполук, їх склад і відносну стійкість без поділу суміші на складові частини.
Побудову й аналіз фазових діаграм застосовують для вибору оптимального режиму технологічних процесів синтезу й очищення біологічно активних і лікарських речовин, а також у фармацевтичному аналізі для ідентифікації і визначення ступеня чистоти лікарських препаратів. Дані термічного аналізу використовують у фармації для підбору основ супозиторіїв, при з'ясуванні причин несумісності лікарських речовин, а також для вивчення їх поліморфних перетворень з метою прогнозування оптимальної біологічної активності.
Закон розподілу третьої речовини між двома розчинниками, що не змішуються, лежить в основі процесів екстракції, які широко використовують у фармації для добування біологічно активних речовин із природної сировини, очистки антибіотиків та інших лікарських речовин, для аналітичних цілей, для виділення лікарських речовин та отрут при проведенні хіміко-токсикологічних досліджень.
Коефіцієнт розподілу лікарської речовини між водною та ліпофільною фазами є важливою фізико-хімічною характеристикою, що визначає як транспортну здатність речовини в організмі, так і можливість її зв'язування з конкретним рецептором. Вивчення зв'язку між фармакологічною активністю лікарської речовини та її коефіцієнтом розподілу дозволяє підвищити ефективність направленого пошуку біологічно активних речовин і інтерпретувати механізм їх дії.
Закон розподілу Нернста дає можливість визначити коефіцієнт розподілу:

івиправдовується для тих випадків, коли додавання речовини до системи не викликає зміни взаємної розчинності рідких фаз і якщо розчинена речовина у кожній із фаз перебуває в однаковому молекулярному стані:
Частіше застосовують рівняння, в яких ураховують вплив дисоціації і асоціації молекул речовини на величини рівноважних концентрацій, наприклад, рівняння Шилова – Лєпінь:

де т – показник за сталої температури, який не залежить від концентрації і характеризується властивостями усіх трьох компонентів, що складають систему:

де М2 (I)і М2 (II)– молярна маса розчиненої речовини в першому і другому розчинниках.
У тих випадках, коли молярні маси речовин, що розподіляються, в обох фазах відомі, коефіцієнт розподілу розраховують за відповідним рівнянням. Наприклад, згідно із спектроскопічними і кріометричними даними карбонові кислоти існують у неполярних розчинниках в основному в вигляді подвійних молекул, утворених за рахунок водневих зв'язків. Так, для оцтової кислоти в неполярній органічній фазі характерне утворення димерів. У воді оцтова кислота незначно дисоціює. Якщо прийняти, що у неполярному розчиннику (СНСlз та ін.) проходить повна асоціація молекул кислоти, і знехтувати її дисоціацією у воді, то т буде дорівнювати 2 і рівняння розподілу для цього граничного випадку приймає форму
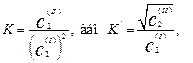
де c2(І) і c2(ІІ)– рівноважні концентрації кислоти відповідно у воді і неполярному розчиннику.
У загальному випадку важко передбачити, чи буде молярна маса розчиненої речовини однаковою в обох рідких фазах. Тому експериментально визначають ряд рівноважних концентрацій речовини в першому і другому розчинниках і, підставляючи значення с1 та с2у лінійну форму рівняння Шилова–Лєпінь

 розраховують К і т.
розраховують К і т.
Із закону розподілу випливає, що розчинену речовину можна добути з розчину, якщо додати до нього другий розчинник, який не змішується з першим. Екстракцією називається процес добування однієї або кількох речовин із складних систем (рідких або твердих) селективним розчинником, який називається екстрагентом.
Метою екстракції є поділ сумішей, підвищення концентрації будь-якої речовини, звільнення розчинника від домішок, заміна розчинника.
У фармацевтичній практиці екстракцію часто проводять з твердого матеріалу, наприклад, з сировини рослинного чи тваринного походження.
Для проведення екстракції використовують спеціальні апарати – екстрактори, в які поміщають вихідну суміш та розчинник (екстрагент). В результаті екстракції утворюються екстракт – розчин добутих компонентів в екстрагенті та рафінат – суміш, у якій концентрація цих компонентів буде меншою. Процес екстракції можна представити такою схемою:

Обчислимо масу тn речовини, яка залишиться у розчині (рафінаті) після п екстракцій однаковими об'ємами екстрагенту V. Нехай у вихідному розчині об'ємом V0 міститься m0 г речовини, що добувається. Після додавання першої порції екстрагенту об'ємом V увихідному розчині залишиться m1 г, а екстрагується (т0 – т1) г речовини. Тоді концентрації речовини після встановлення рівноваги у системі будуть: у рафінаті – c2(І) = m1/V0, в екстракті – c2(ІІ) = (m0–m1)/V.
Згідно із законом розподілу
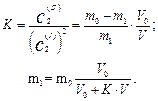
 Останній вираз використовують у розрахунках при одноступінчастій екстракції. Проте в цьому випадку у рафінаті ще залишається багато недобутої речовини, тому на практиці процес екстракції повторюють кілька разів, додаючи до вихідної суміші послідовно порції свіжого екстрагенту однакового об'єму.
Останній вираз використовують у розрахунках при одноступінчастій екстракції. Проте в цьому випадку у рафінаті ще залишається багато недобутої речовини, тому на практиці процес екстракції повторюють кілька разів, додаючи до вихідної суміші послідовно порції свіжого екстрагенту однакового об'єму.
Тоді після другої екстракції:
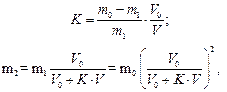
де т2 – маса речовини, яка залишилася у розчині після другої екстракції. Після п екстракцій у першому розчині залишається тn г речовини:

Це рівняння застосовується для розрахунку матеріального балансу при багатоступінчастій екстракції.Послідовне п- кратне екстрагування певним об'ємом розчинника, поділеним на порції, більш ефективне, ніж одноразове добування тим же загальним об'ємом екстрагенту.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2462; Нарушение авторских прав?; Мы поможем в написании вашей работы!