
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади виконання завдань. При виконанні завдань цього розділу див
|
|
|
|
При виконанні завдань цього розділу див. табл. 4.
Приклад 1. Як зміниться ентропія при перетвореннях:
а) води в пару;
б) 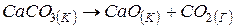 . Чому?
. Чому?
Розв’язання.
а) Перехід 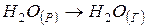 супроводжується збільшенням невпорядкованості системи і тому зростанням ентропії
супроводжується збільшенням невпорядкованості системи і тому зростанням ентропії 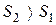 .
.
Оскільки 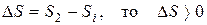
б) Перехід 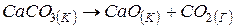 також супроводжується збільшенням невпорядкованості системи, тому що утворюється газоподібна речовина
також супроводжується збільшенням невпорядкованості системи, тому що утворюється газоподібна речовина 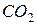 . Ентропія системи збільшується, тобто
. Ентропія системи збільшується, тобто 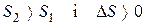 .
.
Приклад 2. Відновлення 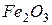 воднем відбувається за рівнянням
воднем відбувається за рівнянням
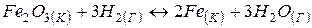 .
.
Чи можлива ця реакція за стандартних умов?
Розв’язання. Для відповіді на запитання слід обчислити 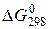 прямої реакції. Знаючи, що
прямої реакції. Знаючи, що 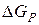 є функцією стану, і що
є функцією стану, і що 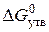 простих речовин дорівнюють нулю, знаходимо
простих речовин дорівнюють нулю, знаходимо 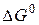 процесу, використовуючи перший наслідок із закону Гесса
процесу, використовуючи перший наслідок із закону Гесса
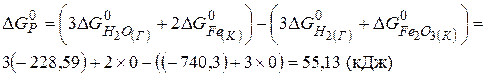
Відповідь. Реакція неможлива, оскільки 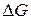 > 0.
> 0.
Приклад 3. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити зміну енергії Гіббса в реакції відновлення оксиду заліза (III) воднем і визначти можливість самочинного перебігу цієї реакції за стандартних умов.
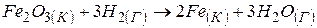 .
.
Розв’язання. Згідно з законами термодинаміки самочинно можуть перебігати тільки ті реакції, які супроводжуються зменшенням енергії Гіббса, тобто для яких 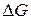 < 0.
< 0.
Враховуючи, що 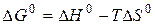 , знаходимо
, знаходимо 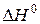 і
і 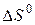 реакції
реакції
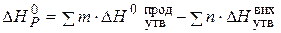
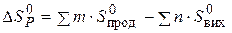
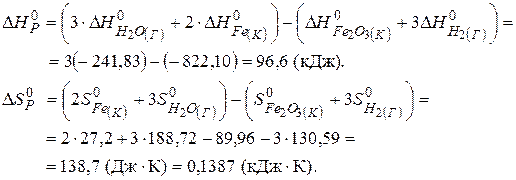
Знаходимо 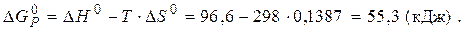
Відповідь. Оскільки 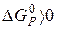 то самочинний перебіг даної реакції за стандартних умов неможливий.
то самочинний перебіг даної реакції за стандартних умов неможливий.
Приклад 4. Виходячи з припущення, що 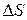 і
і 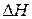 не залежать від температури, визначити за якої температури рівновага системи
не залежать від температури, визначити за якої температури рівновага системи
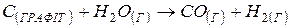
зміститься вправо?
Розв’зання. Відповідно до законів термодинаміки критерієм можливості перебігу хімічних реакцій є зміна ізобарно-ізотермічного потенціалу (енергії Гіббса) 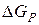 . Самочинно можуть відбуватися тільки ті процеси, для яких він зменшується, тобто
. Самочинно можуть відбуватися тільки ті процеси, для яких він зменшується, тобто 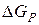 <0. Якщо
<0. Якщо 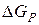 >0, то процес самочинно відбуватися не може. При
>0, то процес самочинно відбуватися не може. При 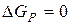 система знаходиться в рівновазі.
система знаходиться в рівновазі.
Знаходимо температуру, при якій встановиться рівновага даної реакції, із співвідношення
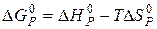 .
.
Оскільки умовою рівноваги є 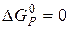 , то і
, то і 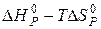 =0.
=0.
Тоді 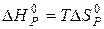 і
і 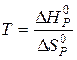 .
.
Починаючи з цієї температури, можливий самочинний перебіг реакції. Цю температуру називають температурою початку реакції. Використовуючи перший наслідок із закону Гесса, знаходимо 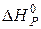 та
та 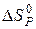 .
.
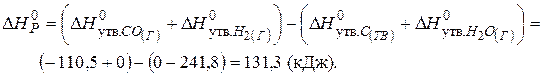
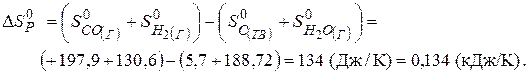
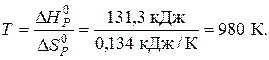
Отже, при 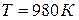 в системі встановиться рівновага, тобто однаково ймовірні прямий та зворотний напрямки реакцій. При температурах, що перевищують 980К, рівновага зміститься вправо, тобто відбуватиметься пряма реакція, а при температурах нижче 980К рівновага зміститься вліво, відбуватиметься зворотна реакція.
в системі встановиться рівновага, тобто однаково ймовірні прямий та зворотний напрямки реакцій. При температурах, що перевищують 980К, рівновага зміститься вправо, тобто відбуватиметься пряма реакція, а при температурах нижче 980К рівновага зміститься вліво, відбуватиметься зворотна реакція.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!