
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади виконання завдань. При виконанні завдань цього розділу див
|
|
|
|
При виконанні завдань цього розділу див. табл. 4.
Приклад 1. Визначити кількість теплоти, що виділяється при згорянні 112 л (н.у.) сірководню, якщо продуктами реакції є пари води і оксид сірки (1V). Термохімічне рівняння реакції горіння сірководню має вигляд:
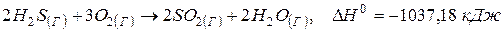 .
.
Розв’язання. Як видно з термохімічного рівняння, при згорянні 2 моль, тобто 2·22,4 л (взятих за н.у.), сірководню виділяється 1037,18 кДжтеплоти. Тому кількість теплоти, що виділяється при згорянні 112 л  , може бути розрахована з пропорції:
, може бути розрахована з пропорції:
 44,8 л 1037,8 кДж
44,8 л 1037,8 кДж
 112 л х кДж
112 л х кДж
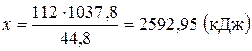 .
.
Приклад 2. Визначити об’єм (н.у.) і масу сірководню, необхідного для реакції
 ,
,
якщо при цьому виділяється 2592,95 кДж. теплоти.
Розв’язання. Як видно з термохімічного рівняння, при згорянні 2 моль, тобто 2х22,4 л (взятих за н.у.), сірководню виділяється 1037,18 кДж теплоти. Тому об’єм H 2 S, необхідний для виділення 2592,95 кДжтеплоти, може бути розрахований з пропорції:
 2·22,4 л 1037,8 кДж
2·22,4 л 1037,8 кДж
 х л 2592,95 кДж
х л 2592,95 кДж
 (л).
(л).
Для знаходження маси H 2 S необхідно знати молярну масу  = 1· 2+32=34 г/моль.
= 1· 2+32=34 г/моль.
Маса 1 моль займає об’єм 22,4 л за нормальних умов. Тоді масу H 2 S можна розрахувати з пропорції:
 34 г 22,4 л
34 г 22,4 л
 х г 112 л
х г 112 л
 (г).
(г).
Приклад 3. Визначити кількість теплоти, що виділяється при гашенні 100 кг вапна водою, якщо термохімічне рівняння має вигляд:
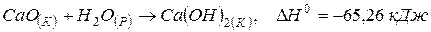
Розв’язання. Як видно з термохімічного рівняння, при гашенні 1 моль вапна виділяється 65,26 кДжтеплоти, а при гашенні 1 кмоль вапна – 65260 кДж. 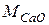 = 56 г/моль = 56 кг/кмоль. Тому кількість теплоти, що виділяється при гашенні 100 кг СаО може бути розрахована з пропорції:
= 56 г/моль = 56 кг/кмоль. Тому кількість теплоти, що виділяється при гашенні 100 кг СаО може бути розрахована з пропорції:
 56 кг 65260 кДж
56 кг 65260 кДж
 100 кг х кДж
100 кг х кДж
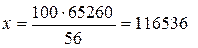 (кДж).
(кДж).
Приклад 4. Визначити масу вапна, необхідну для реакції
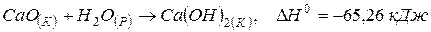 ,
,
якщо при цьому виділяється 116536 кДж теплоти.
Розв’язання. Як видно з термохімічного рівняння, при гашенні 1 моль вапна виділяється 65,26 кДж теплоти. 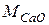 = 56 г/моль. Тому маса СаО, необхідна для виділення 116536 кДжтеплоти, може бути розрахована з пропорції:
= 56 г/моль. Тому маса СаО, необхідна для виділення 116536 кДжтеплоти, може бути розрахована з пропорції:
 56 г 65,26 кДж
56 г 65,26 кДж
 х г 116536 кДж
х г 116536 кДж
 (г) = 100 (кг).
(г) = 100 (кг).
Приклад 5. При розчиненні 1 моль безводного сульфату міді в досить великій кількості води виділяється 66,1 кДж теплоти, а при розчиненні 1 моль кристалогідрату  поглинається 11,7 кДж теплоти. Розрахувати теплоту гідратації сульфату міді.
поглинається 11,7 кДж теплоти. Розрахувати теплоту гідратації сульфату міді.
Розв’язання. Під теплотою гідратації солі розуміють тепловий ефект реакції утворення 1 моль кристалогідрату з безводної солі
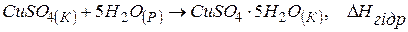 . (1)
. (1)
Виходячи з умов задачі, можна записати термохімічні рівняння:
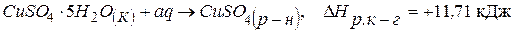 ; (2)
; (2)
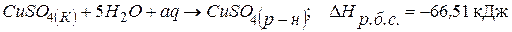 . (3)
. (3)
Задача розв’язується на основі закону Гесса: тепловий ефект реакції не залежить від шляху її перебігу, а залежить лише від природи і фізичного стану вихідних речовин та продуктів реакції. З термохімічними рівняннями можна оперувати так само, як і з алгебраїчними. Отже, щоб отримати рівняння (1) необхідно від рівняння (3) відняти рівняння (2) і тоді
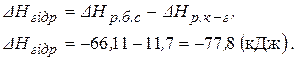
Приклад 6. Визначити тепловий ефект реакції:
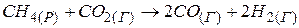
за відомими величинами стандартних теплот утворення речовин.
Розв’язання. Для цього використовуємо перший наслідок із закону Гесса:
 .
.
Значення  речовин беремо в таблиці 4:
речовин беремо в таблиці 4:

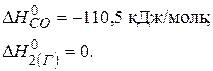
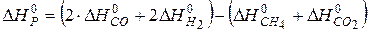 .
.
Враховуючи, що теплоти утворення простих речовин умовно прийняті рівними нулю, отримуємо:
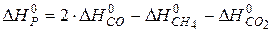 ,
,
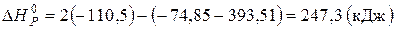 .
.
Відповідь: 247,36 кДж.
 Приклад 7. Знайти теплоту утворення
Приклад 7. Знайти теплоту утворення 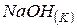 , використовуючи теплоти утворення
, використовуючи теплоти утворення  і тепловий ефект реакції
і тепловий ефект реакції
Розв’язання. Для знаходження теплоти утворення 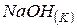 використовуємо перший наслідок із закону Гесса:
використовуємо перший наслідок із закону Гесса:
 .
.
Значення  речовин беремо в таблиці 4:
речовин беремо в таблиці 4:
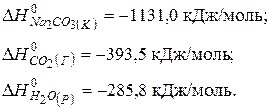
Тоді
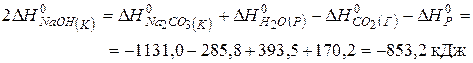
 (кДж/моль).
(кДж/моль).
Відповідь: -426,6 кДж/моль.
Приклад 8. Визначити теплотворну здатність бензолу 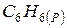 , якщо теплота згоряння його становить
, якщо теплота згоряння його становить 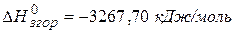 .
.
Розв’язання. Під теплотворною здатністю розуміють теплоту, що виділяється при згорянні 1 кг твердого та рідкого палива або 1 м3газоподібного. Виходячи з умов задачі, при згорянні 1 моль або 78 г бензолу виділяється 3267,70 кДж теплоти. Звідси можна скласти пропорцію:

Відповідь: 41893,59 кДж/кг
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 598; Нарушение авторских прав?; Мы поможем в написании вашей работы!