
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади виконання завдань. Приклад 1. З 4 г металу утворилось 6,632 г оксиду
|
|
|
|
Приклад 1. З 4 г металу утворилось 6,632 г оксиду. Знайти молярну масу еквівалента металу.
Розв’язання. У 6,632 г оксиду міститься 4 г металу, а решта – кисень, маса якого становить
 (г).
(г).
Згідно з законом еквівалентів маємо:
 .
.
Звідки знаходимо:
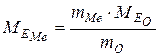 ,
,
 (г/моль),
(г/моль),
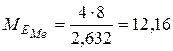 ( г/моль).
( г/моль).
Приклад 2. Знайти, в якій кількості NaOH міститься стільки ж моль еквівалентів, скільки в 147 г  .
.
Розв’язання.  ( г/моль).
( г/моль).
Кількість моль еквівалентів ν сірчаної кислоти в 147 г дорівнює:
ν  (моль екв).
(моль екв).
Оскільки  (г/моль), то
(г/моль), то
маса 3 моль еквівалентів NaOH дорівнює:
 ,
,
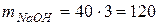 (г).
(г).
Приклад 3. Визначити тиск 3 л газу при деякій температурі, якщо за тієї самої температури тиск 5 л цього газу становить 60,8·103 Па.
Розв’язання. Згідно з законом Бойля-Маріотта при сталій температурі об’єм даної кількості газу обернено пропорційний тиску, під яким він знаходиться, тобто
 . Звідси
. Звідси  Па.
Па.
Приклад 4. Визначити загальний тиск газів у посудині об’ємом 25 л, якщо в неї помістити 0,010 м 3 етилену під тиском 60435 Па і 0,020 м 3 метану під тиском 85670 Па.
Розв ’ язання. Згідно з законом Бойля-Маріотта  визначаємо парціальні тиски кожного з газів у посудині об’ємом 0,025 м3:
визначаємо парціальні тиски кожного з газів у посудині об’ємом 0,025 м3:
 (Па).
(Па).
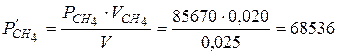 (Па).
(Па).
Загальний тиск газової суміші дорівнює сумі парціальних тисків газів (закон Дальтона):
Рзаг= 24174+68536=92710 (Па).
Приклад 5. Який об’єм за нормальних умов займе кисень масою 8 г?
Розв ’ язання. Молярна маса кисню  32 г/моль. Знаходимо об’єм кисню, користуючись наслідком із закону Авогадро:
32 г/моль. Знаходимо об’єм кисню, користуючись наслідком із закону Авогадро:
32 г О2 займає об’єм 22,4 л
8 г х л
 (л).
(л).
Приклад 6. Знайти масу 50 л азоту (н.у.).
Розв ’ язання. Молярна маса азоту  = 28 г/моль. Користуючись наслідком із закону Авогадро, складаємо пропорцію:
= 28 г/моль. Користуючись наслідком із закону Авогадро, складаємо пропорцію:
28 г N2 займають об’єм 22,4 л
х г N2 50 л
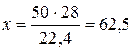 (г).
(г).
Приклад 7. Визначити в грамах масу молекули 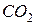 .
.
Розв ’ язання. Молярна маса  г/моль
г/моль
1 моль  містить в собі 6,02·1023 молекул
містить в собі 6,02·1023 молекул  .
.
Отже маса молекули  дорівнює:
дорівнює:
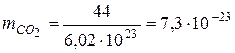 (г).
(г).
Приклад 8. Маса 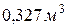 газу при 130С і тиску 1,04·105 Па дорівнює 828 г.. Визначити молярну масу газу.
газу при 130С і тиску 1,04·105 Па дорівнює 828 г.. Визначити молярну масу газу.
Розв’язання. Молярну масу газу можна визначити, користуючись рівнянням Менделєєва-Клапейрона:

Значення універсальної газової сталої обираємо у відповідності до одиниць вимірювання. Якщо тиск виміряється в Па, а об’єм у м3, то  Дж/моль·К.. Молярна маса газу дорівнює:
Дж/моль·К.. Молярна маса газу дорівнює:
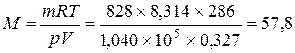 (г/моль).
(г/моль).
Приклад 9. Яка маса оксиду кальцію потрібна для утворення 49 г гідроксиду кальцію?
Розв’язання. Задача розв’язується на підставі рівняння хімічної реакції
 .
.
Оскільки 1 моль оксиду кальцію утворює 1 моль гідроксиду кальцію, то враховуючи молярні маси цих речовин 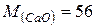 г/моль,
г/моль,  г/моль, можна скласти пропорцію:
г/моль, можна скласти пропорцію:
 56 г
56 г 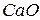 74 г
74 г  г
г
 х г
х г 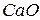 49 г
49 г 
Звідси: 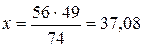 (г).
(г).
Отже, для одержання гідроксиду кальцію масою 49 г необхідно взяти 37,08 г оксиду кальцію.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 370; Нарушение авторских прав?; Мы поможем в написании вашей работы!