
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні поняття та визначення
|
|
|
|
РОЗЧИНИ ЕЛЕКТРОЛІТІВ
| Електроліти | - речовини, які в розчинах та розплавах розпадаються на іони, внаслідок чого їхні розчини та розплави проводять електричний струм. |
| Електролітична дисоціація (або іонізація) | - процес розщеплення електролітів на іони в середовищі полярних розчинників. |
| Ступінь електролітичної дисоціації (α) | - відношення числа молекул, які розщепилися на іони (N дис) до загального числа розчинених молекул (N):
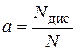
|
| Сильні електроліти | - електроліти, які у розчинах практично повністю дисоціюють на іони; для них 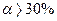 . .
|
| Слабкі електроліти | - електроліти, які під час розчинення у воді лише частково дисоціюють на іони, а основне число їхніх молекул перебуває в розчині в недисоційованому стані; для них 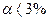 . .
|
| Кислоти | - електроліти, що дисоціюють з відщепленням іонів 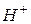 . .
|
| Основи | - електроліти, що дисоціюють з відщепленням іонів 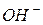 . .
|
| Амфотерні електроліти | - електроліти, які дисоціюють і як кислоти, і як основи. |
| Константа дисоціації (Кд) | - константа рівноваги для оборотного процесу дисоціації слабкого електроліту
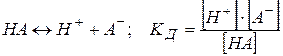 ,
де ,
де 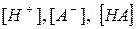 - рівноважні концентрації іонів та недисоційованих молекул слабкого електроліту. - рівноважні концентрації іонів та недисоційованих молекул слабкого електроліту.
|
| Закон розведення Оствальда | - при розведенні розчинів слабких електролітів ступінь дисоціації збільшується
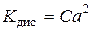 або або 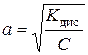
|
| Іонний добуток води | - добуток концентрацій іонів 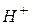 і і 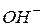
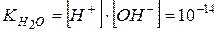 при t = 250C. при t = 250C.
|
| Водневий показник (рН) | - від’ємний десятковий логарифм молярної концентрації іонів Н+ в розчині
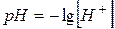
|
| Гідроксидний показник (рОН) | - від’ємний десятковий логарифм молярної концентрації іонів 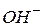
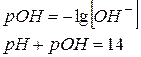
|
| Скорочені іонні рівняння | - рівняння реакцій, в яких сильні розчинні електроліти записують у вигляді іонів, а слабкі розчинні електроліти, важкорозчинні та газоподібні речовини – у молекулярній формі. |
| Гідроліз солей | - реакція обмінної взаємодії між водою і розчиненими в ній солями, що супроводжується зміною рН середовища внаслідок утворення слабкої кислоти (її кислої солі) або слабкої основи (її основної солі). |
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 501; Нарушение авторских прав?; Мы поможем в написании вашей работы!