
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади виконання завдань
|
|
|
|
Приклад 1. Визначити ступінь дисоціації вугільної кислоти за першим ступенем у 0,1 М розчині, якщо константа дисоціації для цього ступеня дорівнює 4,5·10 -7.
Розв’язання. Константа дисоціації і ступінь дисоціації слабкого електроліту зв’язані між собою співвідношенням (закон розведення Оствальда):
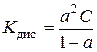 ,
,
де 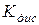 - константа дисоціації; С – концентрація електроліту, (моль/л).
- константа дисоціації; С – концентрація електроліту, (моль/л).
Для розчинів слабких електролітів, які дуже малою мірою дисоціюють на іони, ступінь електролітичної дисоціації набагато менший одиниці (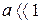 ). Тому рівняння закону розведення Оствальда можна спростити (оскільки за таких умов
). Тому рівняння закону розведення Оствальда можна спростити (оскільки за таких умов 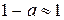 ):
):
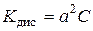 ,
,
звідки
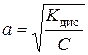 .
.
Вугільна кислота дуже слабка, тому для обчислення ступеня дисоціації скористаємося спрощеним виразом закону розведення
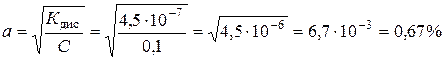 .
.
Відповідь. Ступінь дисоціації вугільної кислоти за першим ступенем дорівнює 6,7·10 -3 або 0,67%.
Приклад 2. Визначити концентрацію іонів 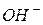 в 0,1 М розчині гідроксиду амонію, якщо Кдис=1,77·10 - 5.
в 0,1 М розчині гідроксиду амонію, якщо Кдис=1,77·10 - 5.
Розв’язання. Концентрація іонів 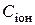 в розчині електроліту залежить від молярної концентрації електроліту СМ, ступеня його дисоціації α і числа іонів n даного виду, що утворюються при дисоціації електроліту, тобто
в розчині електроліту залежить від молярної концентрації електроліту СМ, ступеня його дисоціації α і числа іонів n даного виду, що утворюються при дисоціації електроліту, тобто
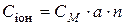
Для визначення концентрації іонів 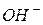 в розчині
в розчині 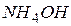 спочатку знаходимо ступінь дисоціації
спочатку знаходимо ступінь дисоціації  :
:
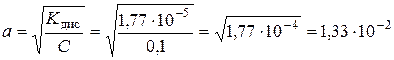 .
.
Запишемо рівняння дисоціації 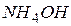 :
:
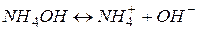 .
.
Оскільки з одного моль 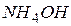 утворюється 1 моль іонів
утворюється 1 моль іонів 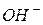 , то концентрація іонів
, то концентрація іонів 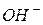 дорівнює
дорівнює
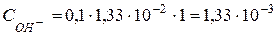 (моль/л).
(моль/л).
Відповідь: 1,33·10-3 моль/л.
Приклад 3. Скласти молекулярні і іонні рівняння реакцій взаємодії між хлоридом барію та сульфатом натрію.
Відповідь. Обмінні реакції між електролітами необоротні і відбуваються до кінця в таких випадках, коли утворюються малорозчинні або газоподібні речовини, а також слабкі електроліти.
В іонних рівняннях сильні електроліти записують у вигляді іонів, на які вони дисоціюють, а малорозчинні і газоподібні речовини, а також слабкі електроліти – у вигляді молекул.
1.Складаємо рівняння реакції в молекулярній формі:
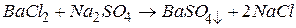
2. Речовини  і
і 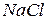 - розчинні у воді солі, які практично цілком дисоціюють на іони, тому в іонному рівнянні ці речовини слід зобразити у вигляді іонів, на які вони дисоціюють. Сіль
- розчинні у воді солі, які практично цілком дисоціюють на іони, тому в іонному рівнянні ці речовини слід зобразити у вигляді іонів, на які вони дисоціюють. Сіль  практично нерозчинна у воді, тому її формулу залишаємо без змін. Тоді маємо:
практично нерозчинна у воді, тому її формулу залишаємо без змін. Тоді маємо:
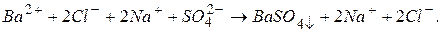
3. Виключаємо з правої та лівої частин однакові кількості однойменних іонів (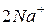 і
і 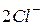 ) і одержуємо рівняння реакції в скороченій іонній формі:
) і одержуємо рівняння реакції в скороченій іонній формі:
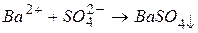 .
.
Приклад 4. Скласти два різних рівняння в молекулярній формі, які відповідають рівнянню в скороченій іонній формі:
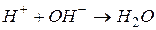
Відповідь. 1. Запишемо під формулами іонів лівої частини рівняння такі іони протилежного заряду, які б утворювали з вихідними іонами розчинні сильні електроліти (дописані іони мають утворювати розчинний сильний електроліт також між собою). Такі самі іони записуємо під формулами іонів правої частини рівняння:
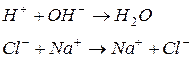
| 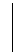 
|
2. Підсумовуючи обидва рівняння, одержуємо рівняння в іонній формі:
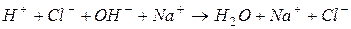 .
.
3. Об’єднуючи іони, записуємо рівняння в молекулярній формі:
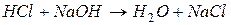 .
.
4. Підбираємо інші відповідні іони й одержуємо друге рівняння реакції:
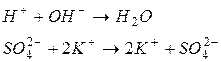
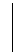
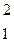
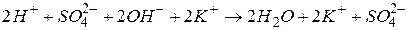
|
або
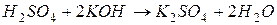 .
.
Приклад 5. Між якими з наведених речовин відбуватиметься реакція обміну в розчині: а) 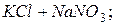 б)
б)  .
.
Відповідь. а) Реакція між розчинами 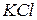 і
і 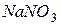 в молекулярній формі виражається рівнянням
в молекулярній формі виражається рівнянням 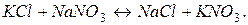
Оскільки всі солі, що приймають участь у цій реакції – сильні електроліти, то в іонному вигляді рівняння реакції можна записати так:
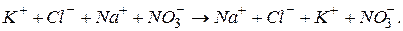
Як показує це рівняння, в розчині утворюється тільки суміш іонів 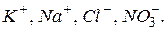 При зливанні розчинів
При зливанні розчинів 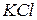 і
і 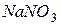 не утворюється ані малорозчинних або газоподібних речовин, ані слабких електролітів. Тому між
не утворюється ані малорозчинних або газоподібних речовин, ані слабких електролітів. Тому між 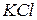 і
і 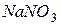 реакція не відбувається.
реакція не відбувається.
б) При зливанні розчинів 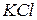 та
та 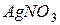 утворюється малорозчинна сіль
утворюється малорозчинна сіль 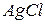 :
:
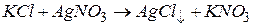 .
.
В іонному вигляді це рівняння записується так:
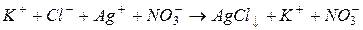
Концентрації іонів 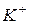 та
та 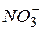 в процесі реакції залишаються незмінними, тому з рівняння реакції їх можна виключити. Тоді рівняння матиме вигляд:
в процесі реакції залишаються незмінними, тому з рівняння реакції їх можна виключити. Тоді рівняння матиме вигляд: 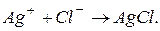 Таким чином, реакція відбувається між іонами
Таким чином, реакція відбувається між іонами 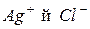 з утворенням осаду
з утворенням осаду 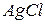 .
.
Приклад 6. Скласти молекулярні і іонні рівняння реакцій взаємодії між: а) гідроксидом амонію і соляною кислотою; б) гідроксидом цинку і гідроксидом натрію.
Відповідь. Якщо вихідними речовинами реакції є малорозчинні речовини або слабкі електроліти, то крім реакцій зв’язування тих чи інших іонів відбуваються реакції поступової дисоціації слабкого електроліту або переходу іонів малорозчинної сполуки в розчин
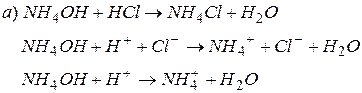
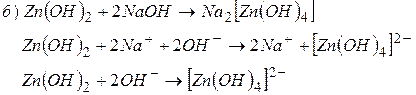
Приклад 7. Визначити концентрацію іонів 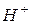 і
і 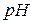 0,01 М розчину гідроксиду натрію, якщо ступінь дисоціації
0,01 М розчину гідроксиду натрію, якщо ступінь дисоціації 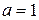 .
.
Розв’язання. Запишемо рівняння дисоціації гідроксиду натрію
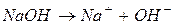
Із рівняння дисоціації видно, що з 1 моль 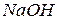 утворюється 1 моль іонів
утворюється 1 моль іонів  ; отже концентрація іонів
; отже концентрація іонів 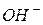 в 0,01 М розчині
в 0,01 М розчині 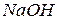 дорівнює:
дорівнює:
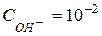 моль/л.
моль/л.
Виходячи з іонного добутку води 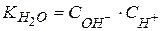 , знаходимо концентрацію іонів водню:
, знаходимо концентрацію іонів водню:

Водневий показник розчину 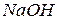 дорівнює:
дорівнює:
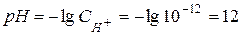 .
.
Приклад 8. Визначити рН 0,17 М розчину 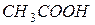 , константа дисоціації якої дорівнює 1,75·10 - 5.
, константа дисоціації якої дорівнює 1,75·10 - 5.
Розв’язання. Кислотність даного розчину обумовлена дисоціацією кислоти
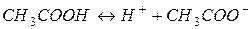
Константа і ступінь дисоціації слабкого електроліту зв’язані між собою співвідношенням
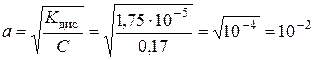 .
.
Визначаємо концентрацію іонів 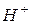 :
:
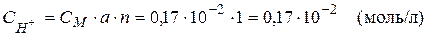 .
.
Звідси водневий показник розчину 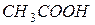 дорівнює:
дорівнює:
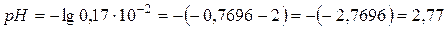 .
.
Приклад 9. Скласти молекулярні та іонні рівняння гідролізу солей: 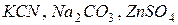 .
.
Відповідь. а) Ціанід калію – сіль, утворена слабкою одноосновною кислотою 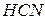 та сильною однокислотною основою
та сильною однокислотною основою 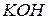 . При розчиненні у воді молекули
. При розчиненні у воді молекули 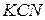 повністю дисоціюють на катіони
повністю дисоціюють на катіони 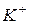 та аніони
та аніони 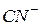 . Катіони
. Катіони 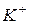 не можуть зв’язувати іони
не можуть зв’язувати іони 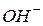 води, бо
води, бо 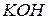 ─ сильний електроліт. Аніони
─ сильний електроліт. Аніони 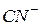 зв’язують іони
зв’язують іони 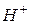 води, утворюючи молекули слабкого електроліту
води, утворюючи молекули слабкого електроліту 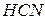 . Сіль гідролізує за аніоном. Скорочене іонне рівняння гідролізу:
. Сіль гідролізує за аніоном. Скорочене іонне рівняння гідролізу:
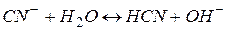
Додаючи до правої і лівої частин рівняння іони калію, одержуємо повне іонне рівняння реакції:
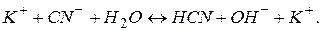
Рівняння реакції гідролізу в молекулярній формі:
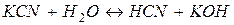 .
.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 626; Нарушение авторских прав?; Мы поможем в написании вашей работы!