
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальні вказівки. Мета роботи - ознайомлення з роботою гальванічного елемента (ГЕ) і вивчення впливу природи електродів на величину ЕРС гальванічного елемента
|
|
|
|
ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Мета роботи - ознайомлення з роботою гальванічного елемента (ГЕ) і вивчення впливу природи електродів на величину ЕРС гальванічного елемента.
Гальванічний елемент – це прилад, що служить для перетворення хімічної енергії окисно-відновної реакції на електричну, причому електрони переходять від відновника до окисника не безпосередньо, а по зовнішньому провіднику (рис.4).
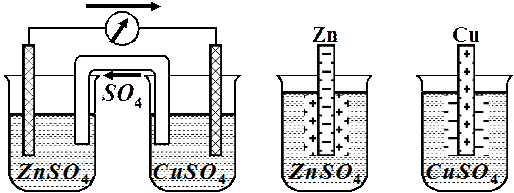
| Рис. 4 | Рис. 5 |
| Схема гальванічного елемента | Схема подвійного електричного шару |
Необхідно розуміти, що в основі роботи ГЕ лежать явища, що відбуваються на межі поділу метал – розчин електроліту. Для цього треба знати, що при зануренні металу в розчин на межі метал – розчин утворюється подвійний електричний шар (рис. 5), що призводить до виникнення стрибка потенціалу (електродний потенціал (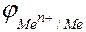 ).
).
Величину електродного потенціалу визначають за рівнянням Нернста, яке для 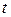 = 25 0С має вигляд:
= 25 0С має вигляд:
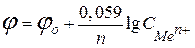 ,
,
де 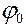 - стандартний електродний потенціал;
- стандартний електродний потенціал;
 - число електронів, які віддає метал;
- число електронів, які віддає метал;
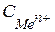 - концентрація іонів металу в розчині.
- концентрація іонів металу в розчині.
Величину 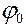 можна знайти в довідкових таблицях (“ряд стандартних електродних потенціалів”). Положення металу в ньому характеризує його відновну здатність, а також окисні властивості його іонів у водних розчинах. Чим менше значення
можна знайти в довідкових таблицях (“ряд стандартних електродних потенціалів”). Положення металу в ньому характеризує його відновну здатність, а також окисні властивості його іонів у водних розчинах. Чим менше значення 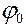 , тим активніший метал, тим сильніші відновні властивості виявляє він у вигляді простої речовини. Так, метал, який стоїть у ряду попереду, здатний витиснути із сполук метали, які стоять за ним.
, тим активніший метал, тим сильніші відновні властивості виявляє він у вигляді простої речовини. Так, метал, який стоїть у ряду попереду, здатний витиснути із сполук метали, які стоять за ним.
При складанні ГЕ треба знати, що більш активний метал завжди є анодом, а менш активний – катодом. При цьому необхідно пам’ятати, що на аноді відбуваються процеси окиснення (віддачі електронів), а на катоді – процеси відновлення (приєднання електронів).
Роботу ГЕ розглянемо на прикладі мідно-цинкового ГЕ (див. рис. 4). На межі поділу фаз виникає різниця потенціалів і встановлюється рівновага:
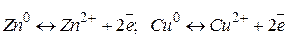
Потенціал цинкового електрода має більш негативне значення, ніж потенціал мідного, тому при замиканні зовнішнього ланцюга і при з’єднанні цинку з міддю металевим провідником електрони будуть переходити з цинкової пластини на мідну. У результаті цього рівновага на цинковому електроді зміститься праворуч, тому в розчин перейде додаткова кількість іонів цинку, в той же час рівновага на мідному електроді зміститься ліворуч і на ньому відбудеться осідання іонів міді з розчину у вигляді атомів.
Таким чином, цинковий електрод буде анодом, на ньому відбувається процес окиснення цинку, а мідний електрод буде катодом, на ньому відбувається процес відновлення іонів міді:

На внутрішній ділянці ланцюга аніони 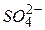 переміщуються від мідного електрода до цинкового, а катіони
переміщуються від мідного електрода до цинкового, а катіони 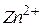 і
і 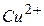 в зворотному напрямку.
в зворотному напрямку.
Сумарний процес виражається рівнянням

Електрохімічні системи ГЕ зображують у вигляді схем, наприклад,
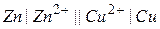
Ознайомившись з роботою гальванічного елемента, необхідно розрахувати його ЕРС за формулою:
ЕРС = 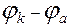 ,
,
де 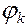 і
і 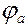 - потенціал відповідно катода і анода.
- потенціал відповідно катода і анода.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 386; Нарушение авторских прав?; Мы поможем в написании вашей работы!