
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальні вказівки
|
|
|
|
Питання для самоперевірки
1. Обчислити потенціал цинкового електрода, зануреного в 0,01 М розчин сульфату цинку; потенціал водневого електрода, зануреного в чисту воду при 25 0С і тиску 1 атм.
2. Скласти схеми роботи двох ГЕ, в одному з яких мідь була б анодом, а в іншому – катодом. Написати рівняння реакцій, що відбуваються при роботі цих елементів, і розрахувати ЕРС елементів у стандартних умовах.
3. Користуючись таблицею стандартних електродних потенціалів, відзначити, який з наведених нижче атомів та іонів може:
а) окиснюватися за допомогою 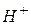 :
:

б) відновлюватися за допомогою 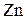 :
:
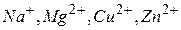 .
.
Скласти молекулярні та іонні рівняння можливих реакцій.
Лабораторна робота № 14
ЕЛЕКТРОЛІЗ
Мета роботи – ознайомлення з процесами, що відбуваються при електролізі водних розчинів солей.
Необхідно чітко уявляти, що суть електролізу пов’язана з окисно-відновними процесами, що відбуваються на електродах при проходженні електричного струму через розплав або розчин електроліту. Як і в гальванічному елементі, на катоді відбуваються процеси відновлення, а на аноді – окиснення.
При розгляданні електролізу водних розчинів треба знати, що, крім іонів розчиненої речовини, в електродних процесах можуть брати участь молекули води.
Катодні процеси. Послідовність розрядження іонів залежить від значень електродних потенціалів. Чим менша величина стандартного електродного потенціалу, тим важче відновлюються його іони. Тому на катоді, в першу чергу, відновлюються катіони металів з найбільшим значенням електродних потенціалів. Необхідно відзначити, що потенціал водневого електрода при 250С у нейтральних розчинах (рН = 7) дорівнює (-0,41 В). Тому при електролізі водних розчинів солей найбільш активних металів (від Li до Al), електродні потенціали яких значно менші ніж – 0,41 В, іони металу не відновлюються, а відновлюються іони водню або молекули води:

Іони металів, розташованих у ряді напруг між Аl і Pb, відновлюються одночасно з іонами водню, оскільки величина його потенціалу (- 0,41 В) близька до значень електродних потенціалів цих металів.
Катіони металів, розташованих у ряді напруг після водню, повністю відновлюються на катоді.
Анодні процеси. Процеси, що відбуваються на аноді, залежать як від електроліту, так і від матеріалу анода. Розрізняють розчинні (активні) аноди (Cu, Aq, Zn, Ni і др.) і нерозчинні (інертні). Наприклад: графіт, платина.
1. Розчинний анод. У цьому випадку окиснюється метал, з якого виготовлений анод:
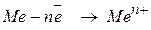
2. Нерозчинний (інертний) анод. При наявності в розчині іонів 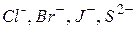 відбувається окиснення цих іонів. Наприклад:
відбувається окиснення цих іонів. Наприклад:
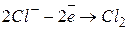
При наявності в розчині аніонів кисневмісних кислот (наприклад, 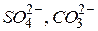 ), а також фторид-іона
), а також фторид-іона  окиснення цих іонів не відбувається, а виділяється кисень завдяки електрохімічному окисненню гідроксид-іонів та молекул води:
окиснення цих іонів не відбувається, а виділяється кисень завдяки електрохімічному окисненню гідроксид-іонів та молекул води:
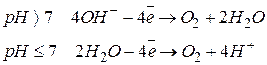
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 460; Нарушение авторских прав?; Мы поможем в написании вашей работы!