
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальні вказівки. Питання для самоперевірки
|
|
|
|
КОРОЗІЯ МЕТАЛІВ
Питання для самоперевірки
Оформлення результатів роботи
Дослід 1. Написати рівняння реакції одержання комплексної сполуки та її координаційну формулу, зважаючи на те, що координаційне число нікелю 6. Вказати, яка основа є більш сильним електролітом: дигідроксид нікелю чи відповідна комплексна основа.
Дослід 2. Написати рівняння відповідних реакцій.
Дослід 3. Написати рівняння реакцій, враховуючи, що координаційне число міді дорівнює 4. Скласти рівняння дисоціації комплексної солі міді та її комплексного іона.
1. Описати зовнішні ознаки комплексоутворення.
2.Написати вираз константи нестійкості комплексної сполуки  .
.
3. Написати хімічні формули таких комплексних сполук: дихлоротетраамін кобальту (III), гексаціанокобальтат(III) натрію, гексафтороферат(III) калію.
Лабораторна робота № 17
Мета роботи - ознайомлення з корозією металів і засобами захисту від неї.
Необхідно чітко уявляти, що корозія металів є гетерогенним процесом, в якому хімічні та електрохімічні процеси відбуваються на межі поділу двох фаз – метал і зовнішнє середовище, причому метал переходить в іонний (окиснений) стан.
Особливу увагу необхідно звернути на електрохімічну корозію, яка відбувається в середовищі електроліту і супроводжується виникненням у системі електричного струму.
Дуже важливо зрозуміти, що при електрохімічній корозії руйнування металу відбувається внаслідок роботи багатьох мікрогальванічних елементів – гальванопар, які утворюються через різницю потенціалів на різних ділянках поверхні металу. Причиною різниці потенціалів можуть бути контакт двох різних металів, наявність домішок у металі, структурна неоднорідність металу та ін. При цьому треба пам’ятати, що анодними є ділянки металу, які мають менше значення електродного потенціалу. На анодних ділянках метал окиснюється, іони металу переходять у розчин і гідратуються, звільняючи зайві електрони, які, залишившись на металі, рухаються до катодної ділянки. На катодних ділянках поверхні металу зайві електрони поглинаються окисником.
Залежно від реакції середовища окисниками при корозії можуть бути іони водню електроліту або розчинений в електроліті кисень повітря. Для прикладу розглянемо корозію заліза, яке має домішки міді, у кислому середовищі (рис.6)
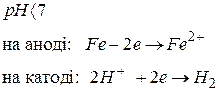
|

Рис. 6 Схема електрохімічної корозії заліза при рН < 7
У результаті залізо руйнується в місці контакту, а на міді виділяється водень.
У нейтральному й лужному середовищах ( ) процес корозії виражається рівняннями:
) процес корозії виражається рівняннями:
 (на аноді)
(на аноді)
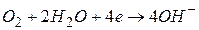 (на катоді)
(на катоді)
 (у розчині)
(у розчині)
Під впливом кисню повітря окиснення  відбувається далі за рівнянням реакції:
відбувається далі за рівнянням реакції:
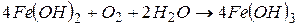
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 341; Нарушение авторских прав?; Мы поможем в написании вашей работы!