
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип Паулі. Електронна структура атомів
|
|
|
|
В багатоелектронному атомі для визначення стану електрона важливе значення має положення, сформульоване в 1925 р. швей-царським фізиком Паулі (принцип Паулі): в атомі не може бути двох електронів, які б мали чотири однакових квантових числа.
З цього випливає, що кожна атомна орбіталь може бути зайнята не більше, ніж двома електронами, спіни яких мають протилежні знаки (антипаралельні).
Число електронів на енергетичному рівні обчислюють за формулою, запропонованою даньським вченим Нільсом Бором:
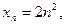
де n - порядковий номер рівня, який дорівнює головному кванто-вому числу.
Якщо 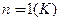 ,
, 
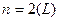 ,
, 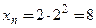
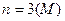 ,
, 
 ,
, 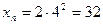
Максимальне число електронів на підрівні визначається за формулою xe = 2(2l+1).
Якщо
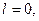
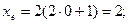
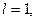


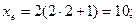

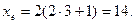
При формуванні енергетичних рівнів і підрівнів атомів виконується принцип мінімуму енергії: черговий електрон стає на той незайнятий підрівень, який характеризується найменшою енергією.
Зростання енергії по енергетичних підрівнях відбувається приблизно в такій послідовності:
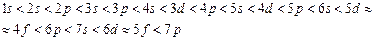
Залежність енергії електрона від значень головного і побічного квантових чисел була вивчена радянським вченим В.Клечков-ським, який сформулював два правила:
1. Послідовне заповнення електронами атомних електронних орбіталей відбувається від орбіталей з меншим значенням суми (n+l) до орбіталей з більшим значенням цієї суми.
2. При однакових значеннях суми (n+l) заповнення орбіталей відбувається в напрямку зростання n.
Наприклад: 1. Розглянемо орбіталі 3 d і 4 s
3 d 
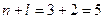
4 s 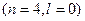
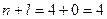
Спочатку заповнюється 4 s -орбіталь, тому що сума (n+l) для цієї орбіталі менша, ніж для 3 d -орбіталі.
Таблиця 6
Розподілення електронів по енергетичних рівнях і підрівнях
| Енер-гетич-ний рівень | Енер-гетич-ний під-рівень | Значення магнітного квантового числа | Число орбіталей | Макси-мальне число електро-нів | ||
| у підрівні | в рівні | на підрівні | на рівні | |||
| K (n =1) | s (l=0) | |||||
| L (n =2) | s (l=0) p (l=1) | -1, 0, +1 | ||||
| M (n =3) | s (l=0) p (l=1) d (l=2) | -1, 0, +1 -2, -1, 0, +1, +2 | ||||
| N (n =-4) | s (l=0) p (l=1) d (l=2) f (l=3) | -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1,0, +1,+2, +3 |
3. Розглянемо орбіталі 3 d, 4 p та 5 s.
3 d 
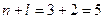
4 p 
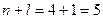
5 s 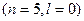
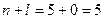
Сума  для цих орбіталей однакова, тому ці орбіталі запов-нюються в напрямку зростання n: 3 d →4 p →5 s.
для цих орбіталей однакова, тому ці орбіталі запов-нюються в напрямку зростання n: 3 d →4 p →5 s.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 550; Нарушение авторских прав?; Мы поможем в написании вашей работы!