
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гібридизація орбіталей
|
|
|
|
Часто в утворенні декількох хімічних зв’язків беруть участь різні атомні орбіталі одного і того ж атома, наприклад, s - і р -орбіталі. Дослід показує, що зв’язки, утворені різними орбіталями, виявляються рівноцінними. Для пояснення цього Л.Полінг ввів уявлення про гібридизацію атомних орбіталей.
Якщо при утворенні хімічного зв’язку беруть участь один s- і один р -електрон, то при комбінації s - і р -орбіталей утворюється дві гібридні sp -орбіталі, розташовані відносно одна одної під кутом 1800 (sp -гібридизація – читається ес-пе-гібридизація). Гібридна sp -орбіталь більше витягнута в одну сторону від ядра, ніж в другу (рис. 11):

(s-p) – орбіта лі дві s p -орбіталі
Рис. 11. sp -Гібридизація валентних орбіталей
Якщо при утворенні хімічних зв’язків відбувається sp - гібридизація, то молекула має лінійну будову. Прикладом може слугувати BeCl2 (рис. 12):

Рис. 12. Лінійна молекула BeCl2
Можливі і інші випадки гібридизації атомних орбіталей. Так, при гібридизації однієї s - і двох р -орбіталей (sp2 -гібридизація – читається ес-пе-два) утворюється три рівноцінні гібридні орбіталі, вони лежать в одній площині і орієнтовані під кутом 1200 одна до одної (рис. 13).
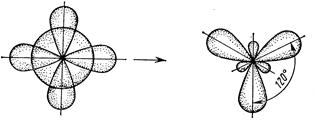
(s+p+p) – орбіталі три sp2 – орбіта лі
Рис. 13. sp2 –Гібридизація валентних орбіталей
Молекула з таким типом гібридизації має форму плоского трикутника з кутом між гібридними орбіталями 1200 (наприклад, BCl3, BF3, рис. 13).
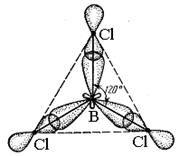
Рис. 14. Трикутна молекула BCl3
Якщо в гібридизації беруть участь одна s - і три р -орбіталі (sp3 -гібридизація), то в результаті утворюється чотири гібридні sp3 -орбіталі, витягнуті в напрямах до вершин тетраедра, тобто орієнтовані під кутами 109028’ одна до одної. (рис. 14):
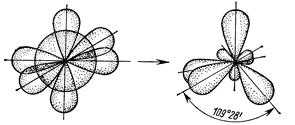
(s+p+p+p) – орбіталі чотири sp3 -орбіталі
Рис. 15. sp3 -Гібридизація валентних орбіталей
Така гібридизація відбувається, наприклад, у збудженому атомі Карбону при утворені молекули метану СН4. Тому молекула метану має форму тетраедра (рис. 16).
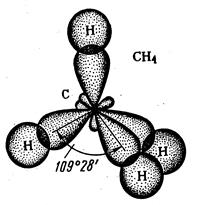
Рис. 16. Перекривання орбіталей в молекулі СН4
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 903; Нарушение авторских прав?; Мы поможем в написании вашей работы!