
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металічний зв’язок
|
|
|
|
Водневий зв’язок
Хімічний зв’язок, який виникає між позитивно поляризованим атомом Гідрогену і негативно поляризованим атомом з великою електронегативністю, наприклад, атомом Флуору, Оксигену або Нітрогену, називають водневим. Він може бути міжмолекулярним і внутрішньомолекулярним. Його виникнення обумовлене частково електростатичною, частково донорно-акцепторною взаємодією.
Процес утворення водневого зв’язку при взаємодії двох молекул HF може бути представлений схемою:
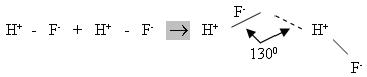
В молекулі HF електронна пара зміщена до атома Флуору, тобто атом Гідрогену поляризований позитивно, а атом Флуору – негативно.
Водневий зв’язок виникає і між молекулами води

Енергія водневого зв’язку лежить в межах 5-25 кДж/моль, вона значно менша за енергію ковалентного зв’язку (150-400 кДж/моль), однак цієї енергії достатньо, щоб спричинити асоціацію молекул. Саме асоціація молекул є причиною аномально високих температур кипіння і плавлення сполук з водневим зв’язком.
Більше 75% елементів періодичної системи – метали. До них належать всі s -елементи, окрім Гідрогену і Гелію, всі d - і f -елементи і частина р -елементів. З погляду будови атомів типові металічні властивості виявляють елементи, які мають невелике число валентних електронів і велику кількість незаповнених орбіталей на зовнішньому енергетичному рівні. Наприклад, розглянемо будову електронної оболонки Літію:
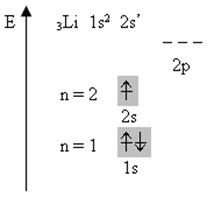
На зовнішньому енергетичному рівні один валентний електрон займає одну з чотирьох орбіталей. При наближенні атомів валентні орбіталі сусідніх атомів перекриваються, завдяки цьому електрони вільно рухаються з однієї орбіталі в іншу, забезпечуючи зв’язок між всіма атомами кристала металу. Електрони стають усуспільненими, утворюючи так званий „електронний газ”(рис. 20).
Отже, металічний зв’язок – це тип зв’язку, зумовлений взаємодією валентних електронів з позитивно зарядженими йонами кристалічних граток металів.

Рис. 20. Схематичне зображення металічної гратки
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1162; Нарушение авторских прав?; Мы поможем в написании вашей работы!