
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплові ефекти реакцій
|
|
|
|
Сутність хімічних реакції полягає в розриві зв’язків в вихідних речовинах і виникненні зв’язків в продуктах реакцій. Оскільки утворення зв’язків відбувається з виділенням енергії, а розрив – з поглинанням, то хімічні реакції супроводжуються енергетичними ефектами. Якщо зв’язки, що руйнуються в вихідних речовинах менш міцні, ніж ті, що утворюються в продуктах реакції, то енергія виділяється, і навпаки. Найчастіше енергія виділяється і поглинається у формі теплоти.
За ознакою виділення чи поглинання теплоти реакції поділяються на екзотермічні і ендотермічні.
Екзотермічні - це реакції, що відбуваються з виділенням теплоти. Наприклад, реакція утворення гідрогенхлориду з водню і хлору: H – H + Cl – Cl = 2 H – Cl + Q. Виграш енергії, обумовлений утворенням двох зв’язків Н-Cl, перевищує витрату енергії на розрив зв’язків Н–Н і Сl–Cl.
Ендотермічні – це реакції, що відбуваються з поглинанням енергії з навколишнього середовища. Наприклад, реакція утворення нітроген(ІІ) оксиду з азоту і кисню: N2 + O2 = 2NO – Q.
Кількість виділеної або поглинутої теплоти називають тепловим ефектом реакції. Рівняння хімічної реакції з вказаним тепловим ефектом називають термохімічним рівнянням.
Тепловий ефект реакції залежить від температури і тиску, тому домовились його відносити до тиску р = 101325Па і температури 298,15 К (250 С). В термохімічних рівняннях вказують стан реагую-чих речовин: кристалічний (к), рідкий (р), газоподібний (г), розчинний (розч.) тощо. Тепловий ефект позначають через ∆Н, виражають в кДж і відносять до тієї кількості моль речовини, яке визначене рівнянням реакції. Можна застосовувати дробові коефіцієнти для вираження теплового ефекту в кДж/моль. У ендотермічних процесів знаки теплових ефектів вважаються додатними (∆Н>0), у екзотермічних від’ємними (∆Н<0).
Якщо всі продукти реакції і вихідні речовини знаходяться в стандартних станах (р =101325Па і Т =298К), то ∆Н називають стандартною ентальпією процесу і позначають ∆Н0298. Тоді для екзотермічної реакції термохімічне рівняння записують так:


Для ендотермічної реакції термохімічне рівняння буде мати вид:
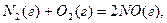

Якщо пряма реакція відбувається з виділенням теплоти, то зворотна буде проходити з поглинанням теплоти, і навпаки.
Виділення або поглинання енергії при перебігу хімічних реакцій вказує на зміну внутрішньої енергії системи.
Термохімічні розрахунки ґрунтуються на законі Гесса (1840р.) і наслідку з нього.
Закон формулюється так: тепловий ефект (зміна ентальпії) реакції залежить тільки від початкового і кінцевого станів реагуючих речовин і не залежить від проміжних стадій процесу.
Сутність закону Гесса можна проілюструвати на прикладі процесу окиснення графіту до карбон(IV) оксиду СО2. Цей процес може відбутись в одну стадію:
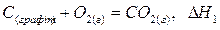
або через проміжну стадію утворення і згоряння СО:
 ;
;
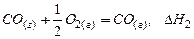 .
.
За законом Гесса при однакових температурі і тиску теплові ефекти прямого згоряння графіту в СО2 або через проміжну стадію утворення СО рівні: ∆Н = ∆Н1 + ∆Н2.
Закон Гесса дозволяє обчислити тепловий ефект реакції, оскільки його не завжди можна визначити експериментально. Так, при згорянні графіту одержується суміш СО і СО2 , тому визначити тепловий ефект утворення СО практично неможливо, але його легко визначити з рівняння: ∆Н1 = ∆Н - ∆Н2.
Наслідок з закону Гесса формулюється так: зміна ентальпії реакції дорівнює різниці між сумою ентальпій (теплот) утворення (∆НУТВ .) продуктів реакції і сумою ентальпій (теплот) утворення вихідних речовин (з врахуванням стехіометричних коефіцієнтів).
Так, для реакції mA + nB = pC + qD. ∆H = (p∆HУТВ.C + q∆HУТВ.D) – (m∆HУТВ.A + n∆HУТВ.B).
Ентальпією (теплотою) утворення називається тепловий ефект реакції утворення одного моль речовини з простих речовин, стійких при стандартних умовах (р = 101325Па, Т = 298К). Стандартні ентальпії (теплоти) утворення позначаються ∆Н0УТВ.,298, часто обидва нижні індекси опускаються. Ентальпії (теплоти) утворення простих речовин, стійких при стандартних умовах, приймаються рівними нулю. Стандартні ентальпії (теплоти) утворення деяких речовин наведені в таблицях. З допомогою таблиць і наслідку з закону Гесса можна обчислити тепловий ефект будь-якої реакції. Наприклад, для реакції взаємодії сульфур(IV) оксиду з гідроген- сульфідом:
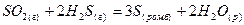
у відповідності з наслідком з закону Гесса запишемо:
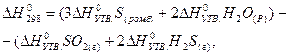
Підставивши табличні дані, (див.додаток, таблиця 3),одержимо:
 кДж.
кДж.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2120; Нарушение авторских прав?; Мы поможем в написании вашей работы!