
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поняття про ентропію
|
|
|
|
Хімічні реакції відбуваються як із зменшенням Н (це екзотер-мічні реакції, для них ∆Н<0), так із збільшенням Н (це ендотермічні реакції, для них ∆Н>0). Але є процеси, які відбуваються, коли ∆Н=0. Наприклад, змішування газів. Припустимо, що два невзаємодіючих між собою гази гелій і неон в посудині відділені один від одного перетинкою і знаходяться під однаковим тиском. Якщо видалити перетинку, то почнеться взаємна дифузія газів. Процес буде відбуватись самовільно і закінчиться при рівномірному розподілі молекул Не і Ne по всьому об’єму. Однак, зворотний процес неможливий. Рухаючою силою змішування газів є намагання перейти в більш імовірний невпорядкований стан.
Для оцінки ступеня невпорядкованності в системі введена функція, названа ентропією. Вона позначається S.
В системах, в яких ∆=0, самовільно відбуваються процеси в напрямку більшої невпорядкованності, тобто збільшення ентропії.
В цьому випадку зміна ентропії ∆S>0 (∆S=S2-S1). Це одне з формулювань другого закону термодинаміки.
Імовірність стану системи W характеризують її логарифмом:
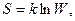
де S – ентропія, k = R/NA, де R – універсальна газова стала, NA - стала Авогадро, W – імовірність стану системи, тобто число мікростанів, через які відбувається даний макростан речовини. Макростан – це стан речовини, що характеризується певними значеннями її макроскопічних властивостей (температура, тиск, об’єм тощо); мікростан – стан речовини, що характеризується певним станом кожної частинки (молекули, атома). Макростан відповідає великому числу різних мікростанів. Той чи інший макростан системи тим більше імовірний, чим більшим числом мікростанів він може здійснитись. Абсолютне значення ентропії можна визначити експериментально. Її розмірність Дж/(моль.К).
Наведемо приклади, що ілюструють поняття ентропії як кількісної міри безладдя.
Якщо реакція відбувається із збільшенням числа молекул, то хаос в системі зростає:
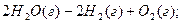
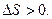
Якщо, навпаки, то ентропія зменшується: 3H2(г)+N2(г)=2NH3 (г); ∆S < 0.
Всі процеси, що супроводжуються зменшенням порядку в системі, супроводжуються збільшенням ентропії. Це розчинення кристалів, плавлення, підвищення температури тощо. І, навпаки, процеси, що відбуваються із збільшенням впорядкованості, супроводжуються зменшенням ентропії. До них належить конденсація, кристалізація, полімеризація, зниження температури тощо.
В розрахунках застосовують стандартні ентропії S0298, визначені при 298К і 101325 Па, (див.додаток, таблиця 3). Для обчислення ∆S0298 користуються наслідком з закону Гесса: зміна ентропії хімічної реакції дорівнює різниці між сумою ентропій продуктів реакції і сумою ентропій вихідних речовин (з врахуванням стехіометричних коефіцієнтів).

Так, для реакції
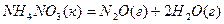
у відповідності з наслідком з закону Гесса запишемо:
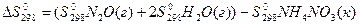 .
.
Підставивши табличні дані (див.додаток, таблиця 3), одержимо:
 Дж/(моль .К)
Дж/(моль .К)
На відміну від ентальпії утворення ентропія простої речовини, яка навіть знаходиться в кристалічному стані, не дорівнює нулю. Це пояснюється тим, що при температурі, яка відрізняється від абсолютного нуля, макростан кристалу може бути реалізований не єдиним мікростаном, а великим числом рівноімовірних мікростанів.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 545; Нарушение авторских прав?; Мы поможем в написании вашей работы!