
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Енергетика хімічних процесів
|
|
|
|
Тема 5. Загальні закономірності перебігу хімічних реакцій
Завдання для самостійного розв’язування
1. Яку валентність можуть виявляти атоми Нітрогену і Фосфору в нормальному і збудженому станах? Для кожного валентного стану вказати електронну формулу останнього енергетичного рівня і розподіл електронів по атомних орбіталях.
2. Які з вказаних атомів не мають вільних орбіталей на зовнішньому енергетичному рівні: O, S, F, Cl?
3. Який з вказаних зв’язків характеризується найбільш електричним моментом диполя: N-H, N-P, O-H, S-H?
4. Вказати як відбувається перетворення електронних орбіталей і тип зв’язків (σ або π) в молекулах H2, Cl2, HF, O2, N2 .
5. Написати електронну формулу і енергетичну схему розподілу електронів по атомних орбіталях для елемента з порядковим номером
7. Яку валентність може виявити цей елемент в нормальному і збудженому стані?
8. Скласти електронні формули та енергетичні схеми елементів: C, Si, O, S, N, P, F, Cl. Яку валентність можуть виявити ці елементи в нормальному та в збудженому станах?
9. Представити валентні схеми утворення хімічних зв’язків в молекулах: Cl2, HCl, H2o, CO2.
10. Вказати типи хімічних зв’язків в молекулах: Br2, CaCl2, H2S, HJ, KBr, SO2, CO2, NaCr, H2, O2, N2.
11. Пояснити механізм утворення зв’язків в йоні гідроксонію Н3О+.
12. Показати перекривання електронних орбіталей в молекулах: а) F2; б) HF; в) H2S; г) NH3.
Важливим завданням хімії є вивчення процесів перетворення речовин – хімічних реакцій. Енергетичні ефекти, напрямок хімічних реакцій, можливість або неможливість самовільного перебігу хімічних процесів вивчає хімічна термодинаміка.
Хімічна термодинаміка необхідна для свідомого управління фізико-хімічними процесами, які лежать в основі хімічного виробництва. Термодинаміка дозволяє здійснювати теоретичний аналіз без попереднього проведення експерименту.
Застосування термодинамічного методу розрахунку в технології різних хімічних виробництв мало в подальшому великий вплив на розвиток всієї хімічної промисловості. Термодинамічний метод широко застосовується в металургійних процесах, при виробництві пластмас, добрив, при хімічній переробці палива. Останнім часом стрімко розвивається біологічні науки, де методи термодинаміки застосовуються при вивченні процесів, що відбуваються в рослинних і тваринних організмах.
Однак термодинамічний метод має свої недоліки і обмеження. Наприклад, передбачаючи можливість і повноту перебігу реакції за певних умов, термодинаміка не дає уявлення про час, необхідний для перебігу реакції. Час, як параметр, що характеризує інтенсивність процесу, не входить в рівняння термодинаміки. Термодинамічний метод може бути застосований тільки до макросистем. Цим методом не можна користуватись при дослідженні окремих атомів, молекул, електронів.
Об’єктом вивчення в хімічній термодинаміці є системи.
Системою називають окрему речовину або сукупність речовин, фізично відокремлених від навколишнього середовища.
Термодинамічні системи поділяються на прості (хімічно однорідні) і складні (хімічно неоднорідні), гомогенні (фізично однорідні) і гетерогенні (фізично неоднорідні), ізольовані (замкнуті) і неізольовані (незамкнуті).
Система, що складається з певної кількості простої або складної речовини, називається простою. Якщо система складається з двох чи більше простих або складних речовин, то вона називається складною.
Прикладами складних систем можуть слугувати:
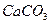 L
L 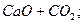
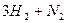 L
L 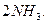
Система, в якій немає поверхні поділу, називається однорідною, або гомогенною. Якщо система складається з декількох речовин, між якими є поверхня поділу, то система називається неоднорідною, або гетерогенною.
Фазою називають частину системи, відокремлену від інших її частин поверхнею поділу, при переході через яку властивості змінюються стрибком. Прикладом гомогенної системи може слугувати будь-яка газова суміш або розчин декількох речовин в одному розчиннику. Вода і лід, насичений осад з розчином – це приклади гетерогенних систем.
Термодинамічна система називається неізольованою, або незамкненою, якщо вона може одержувати або віддавати тепло в навколишнє середовище і виконувати роботу, а зовнішнє середовище – здійснювати роботу над системою.
Система називається ізольованою, або замкнутою, якщо вона не має обміну теплом з навколишнім середовищем, а зміна тиску в системі не впливає на навколишнє середовище і воно не може виконувати роботу над системою.
Властивості будь-якої термодинамічної системи визначаються її параметрами, або незалежними змінними.
В якості основних параметрів системи обирають такі, які можуть бути безпосередньо виміряні. До них належать тиск, температура і об’єм. Ці параметри можуть бути пов’язані між собою рівнянням стану.
Стан системи може бути рівноважним і нерівноважним. Якщо термодинамічні параметри з плином часу не змінюються без будь-якої зовнішньої дії на систему, такий стан називається рівноважним. Стан є нерівноважним, якщо її параметри змінюються при відсутності дії на систему.
Перехід термодинамічної системи з одного стану в інший називається процесом. При будь-якому процесі одні параметри системи залишаються незмінними, інші – змінюються. В залежності від того, які параметри при переході системи з одного стану в інший залишаються постійними, процеси поділяються на ізохорні (при сталому об’ємі), ізобарні (при сталому тиску), ізотермічні (при сталій температурі).
До важливіших величин, які характеризують термодинамічні системи, належать внутрішня енергія U, ентальпія Н, ентропія S та енергія Гіббса (ізобарно-ізотермічний потенціал) G. Всі ці величини – функції стану. Вони залежать тільки від початкового і кінцевого стану системи і не залежать від шляху переходу.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 751; Нарушение авторских прав?; Мы поможем в написании вашей работы!