
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутрішня енергія і ентальпія системи
|
|
|
|
Внутрішня енергія системи - це її повна енергія, яка складається з кінетичної і потенціальної енергії молекул, атомів, атомних ядер і електронів.
Абсолютне значення внутрішньої енергії визначити неможливо, можна визначити тільки її зміну при переході системи з одного стану в інший:
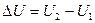
∆U не залежить від шляху переходу, а залежить тільки від початкового і кінцевого стану системи, які визначаються тиском, об’ємом і температурою.
Якщо газ знаходиться в циліндрі з поршнем, то при підведенні теплоти  газ нагрівається (збільшується його внутрішня енергія від U1 до U2) і розширюється (відбувається робота А при переході системи з початкового в кінцевий стан).
газ нагрівається (збільшується його внутрішня енергія від U1 до U2) і розширюється (відбувається робота А при переході системи з початкового в кінцевий стан).

| Q = ∆U + A - це математичний вираз першого закону термодинаміки, який в цьому випадку має таке формулювання: підведена до системи теплота Q використовується на збільшення внутрішньої енергії системи U і на виконання зовнішньої роботи А. |
Перший закон термодинаміки – це закон збереження енергії. Але термодинаміка розглядає переважно дві форми, у вигляді яких відбувається перетворення енергії – теплоту і роботу. Саме тому перший закон термодинаміки і встановлює співвідношення між тепловою енергією (Q) і роботою (А) при зміні загальної енергії системи.
Тоді Q = ∆U+A = (U2-U1)+A. При сталому тиску робота розши-рення газу А дорівнює P(V2-V1). Підставимо значення А в попереднє рівняння і одержимо:

Суму U+PV називають ентальпією і позначають Н: H=U+PV.
Ентальпія – це енерговміст системи, що включає внутрішню енергію і роботу.
Більшість хімічних процесів відбувається при сталому тиску. Це ізобарні процеси. Якщо сталий об’єм, то це ізохорні процеси. Тепловий ефект при ізобарному процесі QP дорівнює зміні ентальпії ∆H: QP = H2 – H1 = ∆H.
Для ізобарного процесу: ∆H = ∑НПРОД-∑НВИХ.Р.
Для ізохорного процесу тепловий ефект дорівнює зміні внутрішньої енергії:
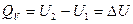
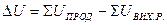
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1881; Нарушение авторских прав?; Мы поможем в написании вашей работы!