
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електрохiмiчна корозія
|
|
|
|
У водi, звичайно, мiститься розчинений кисень (в 100V при 00 С - 5V кисню), здатний до вiдновлення:  .
.
Окрiм того, в водi присутнi йони Гiдрогену, також здатнi до вiдновлення: 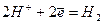 .
.
Розчинений кисень i йони Гiдрогену - найважливiшi окисники, що спричиняють електрохiмiчну корозiю.
Розглянемо, якi метали можуть бути окисненi розчиненим у водi киснем i якi - йонами Гiдрогену. Потенцiал електродного процесу в нейтральному середовищi

дорiвнює:  .
.
Кисень може окиснити тi метали, потенцiал яких менший за 0,8В. Вони розташованi до срiбла.
Потенцiал, що вiдповiдає електродному процесу 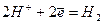 в нейтральному середовищi дорiвнює (- 0,41В).
в нейтральному середовищi дорiвнює (- 0,41В).
Йони Гiдрогену у водi можуть окиснити метали до Сd. Деякi метали мають оксиднi плiвки, тому число металiв ще менше.
При виникненні корозiї в електролiтах (кислотах, лугах, сольових розчинах, морськiй водi) можуть бути два випадки.
а) Включення iнородного металу дуже малi.
При зануреннi залiзної або сталевої пластинки в хлоридну кислоту домішки по вiдношенню до металу будуть катодними дiлянками, а сам метал - анодною дiлянкою. Виникають гальванічні мікроелементи. Основний метал-залізо окиснюється і переходить в розчин у вигляді йонів Fe2+, утворюючи з хлорид-йонами середовища ферум(ІІ) хлорид.
Йони Гідрогену рухаються до катоду (домішки), де, приймаючи електрони, відновлюються. Цей процес можна представити такими рівняннями:
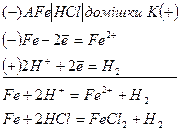
Поверхня металу насичується воднем в результатi адсорбцiї, i процес розчинення металу сповiльнюється.
б) Є контакт рiзних металiв.
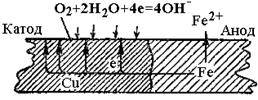
Рис. 36. Атмосферна корозія заліза в контакті з міддю
Наприклад, залiзна пластина в контакті з мідною знаходиться в атмосфері повітря (рис.36). Тодi при атмосфернiй корозiї вiдбудуться такi процеси: руйнується більш активний метал, який є анодом гальванічного елемента; на катоді утворюються йони ОН-, які з’єднуються з йонами Fe2+, що переийшли в розчин, і утворюють ферум(ІІ) гідроксид, який в присутності води і кисню повітря переходить в ферум(ІІІ) гідроксид. Останній частково відщеплює воду, і сполука, що утворилась, відповідає бурій іржі.

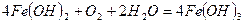

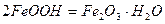
Англійський вчений Вернон вивчав вплив вологості повітря на перебіг корозії і прийшов до висновку, що при відносній вологості до 30% корозія металів практично не відбувається. При підвищнні вологості до 60-70% - корозія повільно посилюється. Максимум спостерігається при відносній вологості вище 70%, але при вологості 90% корозія незначно послаблюється.
Електрохімічна корозія може відбуватись в грунті, що призводить до руйнування трубопроводів, оболонок кабелів, деталей будівельних споруд. Метал стикається з вологою грунту, в якій є розчинене повітря. Інтенсивність корозії в грунті залежить від присутності кислот та інших агресивно діючих речовин, а також від вологості грунту. В грунті з вологістю до 10% метали кородують незначно. Підвищення вологості посилює корозію. При дуже великій вологості корозія практично припиняється через те, що вода, заповнюючи пори грунту, перешкоджає доступу кисню.
Одним з різновидів електрохімічної корозії є корозія, що виникає при нерівномірній аерації, яка спостерігається, коли деталь або конструкція знаходиться в розчині або під краплею води, але доступ розчиненого кисню до різних ділянок неоднаковий. Утворюється особлива гальванопара (рис.37). Та ділянка металу, доступ кисню до якої мінімальний, виступає анодом (кородує сильніше), а ділянка з більшим доступом кисню – катодом.
Це пояснюється тим, що при відновленні кисню витрачаються йони Гідрогену Н+, і розчин підлужнюється. Залізо при підлужнюванні переходить в пасивний стан, і швидкість корозії зменшується.

Рис. 37. Корозія заліза при нерівномірній аерації
Спостерігається також корозія „блукаючими” струмами. Джелером „блукаючих” струмів слугують трамваї, метро, електрозварювальні апарати тощо. В місці входу в підземно-металічну конструкцію струм не спричиняє руйнування, але при виході руйнує метал (рис.38).

Рис. 38. Корозія під дією блукаючих струмів:
1 - провід; 2 – рельс; 3 – вологий грунт; 4 – труба; 5 – електродвигун трамваю;
6 – опір в стику рельси
Стійкість багатьох металів і сплавів по відношенню до дії навколишнього середовища зростає завдяки захисним властивостям продукту корозії – щільної оксидної плівки. Прикладом може слугувати алюміній.
Якщо плівка пухка, то вона посилює корозію. Наприклад, у випадку заліза.
Багато металів при обробці їх окисниками, наприклад HNO3, втрачають здатність кородувати (Al, Fe, Cr та ін.).
Речовини, що сприяють виникненню захисної плівки, називаються пасиваторами.
Деякі речовини сприяють руйнуванню захисної плівки. Вони називаються активаторами корозії. Приклад – йони хлору, розчинений кисень.
Корозія багатьох металів залежить від рН. Наприлад, корозія заліза посилюється із зменшенням рН; корозія металів, які утворюють амфотерні гідроксиди, наприклад цинку, алюмінію посилюється і пониженням, і з підвищенням рН.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 610; Нарушение авторских прав?; Мы поможем в написании вашей работы!