
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Складні ліпіди
|
|
|
|
Воски
Жири
Жири – це естери гліцерину та вищих карбонових кислот. Загальна формула:
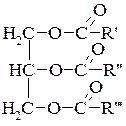
де R′, R″, R″′ – радикали (алкільні залишки) вищих жирних карбонових кислот.
Хімічну природу жирів уперше дослідив у 1822 році французький хімік М. Шеврель, який здійснив їхній гідроліз при нагріванні з водою в присутності лугу. У 1854 році М. Бертло довів будову жирів, отримавши їх шляхом нагрівання гліцерину з вищими жирними кислотами в ампулах.
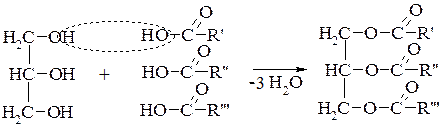
Гліцерин входить до складу усіх природних жирів. Оскільки при лужному гідролізі утворюються карбонові кислоти, останні отримали назву жирні кислоти або за сучасною абревіатурою – ВКК. Зрозуміло, що різниця між різними жирами за фізичними та хімічними властивостями обумовлена виключно кислотами.
Нині відомо біля 50 природних насичених і ненасичених карбонових кислот, найпоширеніші з яких у складі жирів подано у табл. 1.
Таблиця 1. Найважливіші кислоти, які виділені з природних жирів
| Тривіальна назва | Формула | |
| Вищі насичені карбонові кислоти | Масляна (С4) | СН3(СН2)2СООН |
| Капронова (С6) | СН3(СН2)4СООН | |
| Каприлова (С8) | СН3(СН2)6СООН | |
| Капринова (С10) | СН3(СН2)8СООН | |
| Лауринова (С12) | СН3(СН2)10СООН | |
| Міристинова (С14) | СН3(СН2)12СООН | |
| Пальмітинова (С16) | СН3(СН2)14СООН | |
| Стеаринова (С18) | СН3(СН2)16СООН | |
| Арахінова (С20) | СН3(СН2)18СООН | |
| Бегенова (С22) | СН3(СН2)20СООН | |
| Лігноцеринова (С24) | СН3(СН2)22СООН | |
| Церотинова (С26) | СН3(СН2)24СООН | |
| Монтанова (С28) | СН3(СН2)26СООН | |
| Мелісинова (С30) | СН3(СН2)28СООН | |
| Вищі ненасичені карбонові кислоти з одним подвійним зв'язком | Додеценова (С12) | СН3СН2 –СН=СН–(СН2)7СООН |
| Тетрадеценова (С14) | СН3(СН2)3–СН=СН– (СН2)7СООН | |
| Пальмітолеїнова (С16) | СН3(СН2)5–СН=СН(СН2)7СООН | |
| Олеїнова (С18) | СН3(СН2)7СН=СН(СН2)7СООН | |
| Петроселева (С18) | СН3(СН2)10СН=СН(СН2)4СООН | |
| Вакценова (С18) | СН3(СН2)5СН=СН(СН2)9СООН | |
| Ейкозенова (гадолеїнова) (С20) | СН3(СН2)9СН=СН(СН2)7СООН | |
| Ерукова (С22) | СН3(СН2)7СН=СН(СН2)11СООН | |
| Нервонова (С24) | СН3(СН2)7СН=СН(СН2)13СООН | |
| З двома подвійними зв'язками | Лінолева (С18) | СН3(СН2)4СН=СНСН2СН=СН(СН2)7СООН |
| З трьома подвійними зв'язками | Ліноленова (С18) | СН3–(СН2СН=СН)3–(СН2)7СООН |
| Елеостеаринова (С18) | СН3–(СН2)3–(СН=СН)3–(СН2)7СООН | |
| Дигомо-γ-ліноленова (С20) | СН3(СН2)3–(СН2СН=СН)3–(СН2)6СООН | |
| З чотирма подвійними зв'язками | Арахідонова (С20) | СН3(СН2)4–(СН=СНСН2)4–(СН2)2СООН |
| З шістьма подвійними зв'язками | Докозагексенова (С22) | СН3 –(СН=СНСН2)6–(СН2)2СООН |
| З потрійним зв'язком | Тарірова (С18) | СН3(СН2)10–СНºСН– (СН2)4СООН |
| З циклами у вуглецевому ланцюзі | Стеркулова (С20) | 
|
| Хаульмугрова (С18) | 
| |
| Гіднокарпова (С16) | 
| |
| Гідрокси та кетокислоти | Рицинолева (С18) | СН3(СН2)5СН(ОН)СН2СН=СН(СН2)7СООН |
| Ліканова (С18) | СН3(СН2)3(СН=СН)3(СН2)4СО(СН2)2СООН |
Для виділення кислот із жирів використовують різні методи: перегонку метилових ефірів, кристалізацію за низьких температур, утворення комплексів з сечовиною і з циклічними декстринами, хроматографію (паперову та газову – найефективніший метод на сьогодні).
Жирні кислоти, що містять один або більше подвійних зв’язків називаються ненасиченим и карбоновими кислотами (олеїнова – С17Н33СООН, лінолева – С17Н31СООН, ліноленова – С17Н29СООН). Ступінь насиченості жирних кислот, які входять до складу жирів та інших ліпідів, визначає їх агрегатний стан: чим вище ненасиченість жирних кислот та менше атомів Карбону, тим нижче температура топлення. Рідкі жири називають оліями. У складі твердих жирів переважають ацили насичених кислот, а рідких – ацили ненасичених кислот.
Найбільш поширені з кислот містять від 12 до 18 атомів Карбону і мають нерозгалужені карбонові ланцюги з парним числом атомів Карбону. Виключення складають циклічні кислоти (хаульмугрова, стеркулова, гіднокарпова).
З усіх кислот, що містяться в природних жирах найбільш поширена олеїнова кислота. Лінолева та ліноленова менш поширені. Слід зазначити, що лінолева та ліноленова кислоти не синтезуються в організмі тварин і людини і потрапляють тільки з їжею. Вони необхідні для синтезу простагландинів і тромбоксанів. Тому ці кислоти отримали назву незамінні карбонові кислоти. Основними джерелами цих кислот є конопляна, льняна, соняшникова, кукурудзяна олії, олія з насіння ріпаку. Недостатність в організмі лінолевої кислоти може привести до уповільнення зростання і змін в клітинах шкіри, залоз внутрішньої секреції і статевих органів. Недостатність ліноленової кислоти приводить до зниження здібності до навчання.
Ненасичені кислоти з одним подвійним зв'язком зустрічаються в природі в цис -конфігурації. З декількома подвійними зв'язками частіше всього теж знаходяться в цис-( Z)-конфігурації. В 1990 роках з'явився ряд публікацій про шкідливість вживання транс-жирів, які утворюються при термічній обробці жирів і особливо гідрогенізації жирів (виробництво маргарину).
З насичених пальмітинова кислота поширена майже як і олеїнова. Вона входить до складу всіх жирів, причому в деяких жирах вміст її становить 15-50% від загального вмісту всіх кислот. В меншій мірі поширені стеаринова та міристинова кислоти. Великий вміст їх (25% і більше) в овечому та яловичому запасних жирах і в олії тропічних рослин (масло какао). Як правило, якщо насичена кислота міститься в жирі у великій кількості, вона постійно супроводжується невеликими кількостями її вищих та нижчих гомологів. Так жир, головною складовою якого є пальмітинова кислота, містить також міристинову та стеаринову кислоти.
Кількість будь-якої жирної кислоти може змінюватись в широких межах. Тому кислоти, що містяться в жирах, корисно розділити на дві категорії: головні та другорядні. Головні – це кислоти, вміст яких становить більше 10% від загальної маси жиру. Ця кількість може здаватися невеликою, але жири можуть містити до десяти і більше різних кислот. Природні жири можна класифікувати на основі кількості в них головних кислот. Така класифікація співпадає з класифікацією жирів за їх біологічним походженням. Другими словами, жири, що містяться в біологічно споріднених організмах, часто хімічно подібні. Крім того, в багатьох випадках другорядні кислоти можуть бути характерними для певної групи жирів. Наприклад, низькомолекулярні насичені кислоти (масляна) характерні для молока, або пальмітолеїнова – для жирів вищих наземних ссавців (вміст цієї кислоти 2 – 3%).
Вміст ВКК в деяких оліях та жирах наведений в табл. 2.
Таблиця 2. Вміст вищих карбонових кислот, що входять до складу жирів та олій
| Назва олії, жиру | Вміст ВКК,% |
| Масло какао | Міристинова – 0,1 – 0,4; Пальмітинова – 25,5 – 28,0; Стеаринова – 34,1 – 36,7; Олеїнова – 32,1 – 36,5; Лінолева – 2,3 – 3,8; Арахінова – 0,9 – 1,2%. |
| Лляна олія | Ліноленова – 45 – 55; Лінолева – 22 – 30; Олеїнова – 15 – 25; Пальмітинова – 6 – 10%. |
| Касторова олія | Рицинова – 88% |
| Соняшникова олія | Лінолева – 55 – 65; Олеїнова – 33 – 36; Пальмітинова і стеаринова – 5–10%. |
| Соєва олія | Лінолева – 55; Олеїнова – 33; Ліноленова – 3%. |
| Тунгова олія | Олеостеаринова – до 80; Олеїнова – 15%. |
| Оливкова олія | Олеїнова – 80% |
| Коров'яче масло | Масляна – 3,7 – 4; Пальмітинова – 25,4 – 26; Стеаринова – 10,7 – 11,2; Міристинова – 8,1 – 9,3; Олеїнова – 32,4 – 32,8; Лінолева – 3,7 – 4%. |
| Жирова тканина людини | Олеїнова – 55; Ліноленова – 10; Пальмітолеїнова – 5; Пальмітинова – 30%. |
| Жири наземних тварин | Олеїнова – 40 – 60; Пальмітинова – 25 – 30% Лінолева – в невеликій кількості. |
| Жири морських тварин | Широкий діапазон ненасичених кислот С16, С18 , С20 , С22 разом з другорядними кислотами С14, С24. Головна насичена кислота – пальмітинова С16 – 12 – 15%. З ненасичених кислот переважають кислоти ряду С18 – 30 – 45%. Характерною є пальмітоолеїнова –15 – 20% та наявність дуже ненасичених кислот С20, С22 з чотирма, п'ятьма та шістьма подвійними зв'язками. |
Знаючи жирнокислотний склад (табл. 2), наприклад, масла какао можна контролювати фальсифікації цього основного компоненту шоколаду (невідповідність складу ВКК або їх вмісту).
Будова гліцеридів
Природні жири, як правило, є повними естерами, тобто три гідроксила гліцерина етерифіковані трьома залишками вищих карбонових кислот. Такі повні естери гліцерину називають тригліцеридами. Однак зустрічаються і неповні естери, в яких залишок гліцерину зв’язаний лише з одним або двома залишками кислот (моно - і дигліцериди).
Гідроксили гліцерина можуть бути етерифіковані або тільки однією кислотою (наприклад, пальмітиновою або олеїновою), або двома чи трьома різними ВКК. Наприклад, зустрічаються жири, які мають залишки двох або трьох різних кислот:
· олеодистеарин, який має один залишок олеїнової кислоти і два залишки стеаринової кислоти;
· олеопальмітостеарин – має залишки олеїнової, пальмітинової і стеаринової кислот.

Олеодистеарин Олеопальмітостеарин
Тригліцериди які мають три залишки якої-небудь однієї кислоти, зустрічаються лише в небагатьох жирах або отримують синтетично. Жири, які мають залишки однакових кислот (R′ = R″ = R″′) – називають простими. Якщо ж залишки R′, R″, R″′ різні, то такі тригліцериди називають змішаними.
Як уже зазначалося, більшість жирів містять дві чи три головні кислоти і ще деякі інші кислоти в межах кількості. Ці кислоти розподілені таким чином між молекулами гліцерида, щоб при цьому утворювалась по можливості більша кількість змішаних гліцеридів («принцип рівномірного розподілу»). Іншими словами, кожна молекула гліцериду прагне набути найбільш гетерогенний склад.
Наприклад, оливкова олія, незважаючи на те, що вона містить дуже високий відсоток олеїнової кислоти (80% загальної кількості кислот), містить всього 30% триолеїна поряд з 45% діолеїнів з насиченими кислотами (пальмітинової і стеаринової) і 25% лінолеодіолеїнів.
Склад масло какао: 55% – олеопальмітостеарин, 20% – олеодистеарин, тоді як трипальмітин, тристеарин та триолеїн міститься в незначних кількостях.
Склад ялового жиру: 32% – олеопальмітостеарин, 23% – пальмітодіолеїн, 15% – олеодипальмітин, 11% – стеародиолеїн, 17% – гліцеридів насичених кислот (пальмітодистеарин, тристеарин).
У природних тваринних тригліцеридах положення перше і третє зайняті переважно залишками насичених жирних кислот, а друге – ненасичених. У рослинних жирах може бути навпаки. Незважаючи на невеликий набір ВКК (5 – 8), що беруть участь в утворенні гліцеридів, значна кількість різних тригліцеридів пов'язана з різною будовою і положенням ацилів жирних кислот у молекулах тригліцеридів. Згідно з даними А.П. Нечаєва і Т.В. Єрьоменко ця загальна кількість має такий вигляд:
| Кількість різних жирних кислот в жирі | ||||||
| Кількість можливих гліцеридів |
Ізомерія і номенклатура жирів
Ізомерія тригліцеридів пов'язана з різним положенням 1,2,3-арилів у молекулі тригліцериду, їх будовою, положенням подвійного зв'язку, також можлива цис - та транс -ізомерія. Також має місце оптична ізомерія, яка зумовлена наявністю хірального (асиметричного) атома Карбону в положенні С2 , що трапляється в разі різних арилів у першого і третього атомів Карбону гліцерину.
Естери гліцерину зазвичай називають гліцеридами або ж нумерують атоми Карбону гліцерину і зазначають положення замісників, добавляючи при цьому слово гліцерин. Наприклад, 1,2,3-тристеарат гліцерину, або 1,2-дистеарат-3-олеїноат гліцерину.
Оскільки жири – естери вищих жирних кислот і пропантріолу, то систематичну назву можна побудовати за принципом назв естерів:

Пропантриїл-1,2-дигексадеканоат-3-октадецен-9-оат (IUPAC)
або 1,2-дипальмітат-3-олеїноат гліцерину (олеодіпальмітат).
Фізичні властивості
Тригліцериди – тверді або рідкі речовини без смаку, запаху і кольору, з низькими температурами топлення і високими температурами кипіння. Завдяки високим температурам кипіння на них можна жарити їжу і жири не випарюються зі сковороди. Температура топлення залежить від типу кислот, які входять до складу. У гліцеридів спостерігається дивне явище «подвійного топлення». Так, чистий тристеарин топиться при 71°С. Однак, якщо тристеарин розтопити, а потім охолодити, то при повторному нагріванні він плавиться спочатку при 55°С, потім твердне і знову топиться при 71°С. Це явище обумовлено наявністю трьох поліморфних кристалічних форм. Оскільки природні жири – суміш змішаних триацилгліцеридів, вони топляться за різних температур в широкому інтервалі.
Тваринні жири (яловичий, баранячий, свинячий) – тверді, вони містять в основному залишки насичених кислот (пальмітинової і стеаринової).
Рослинні жири (олії) – рідини, молекули яких містять переважно залишки ненасичених кислот (олеїнової, лінолевої, ліноленової) та деяких інших.
Консистенція жирів, тобто ступінь їх густини або м’якості залежить від співвідношення насичених і ненасичених кислот, які входять до складу жирів.
Жири майже не розчинні у воді, спирті, можуть утворювати колоїдні дисперсії та емульсії, які стабілізуються в присутності ПАР (емульгаторів): білків, мила, сульфокислот. Жири дуже мало розчинні у воді. Але добре розчинні в діетиловому та петролейному етерах. Вони легші за воду (r= 0,91).
Для хімічної характеристики жирів використовуютьтак звані числа, які визначаються аналітичним шляхом: число омилення, йодне число та кислотне число.
Число омилення (ЧО) – це число міліграмів калій гідроксиду (КОН), затраченого на нейтралізацію жирних кислот при омиленні 1 г жиру. Чим нижче число омилення, тим більша молекулярна маса жирних кислот, які входять до складу цього жиру, і навпаки, чим вище число омилення, тим менша молекулярна маса кислот, які входять до складу жиру.
У рапсової олії ЧО дорівнює – 172 – 174 (високомолекулярні кислоти), ЧО триолеїну (С18) – 192, коров'ячого жиру – 226, кокосової олії – 246 (низькомолекулярні кислоти).
Йодне число (ЙЧ) є показником ненасиченостіжиру. Йодне число – це кількість грамів йоду, який приєднується (за місцем подвійних зв'язків) до 100 г жиру. Чим вище йодне число – тим більш ненасиченим є даний жир, тим більше подвійних зв’язків міститься в жирних кислотах. Приєднання йоду не відбувається кількісно, тому йодне число має умовне значення і використовується для оцінки якості висихаючих олій (використовуються при виробництві оліфи для приготування фарб) – значення більше 130. Йодне число лляного масла дорівнює 170 – 180. Йодні числа невисихаючих олій менші 90 (оливкова олія – 75 – 88). Соняшникова олія напіввисихаюча – 127 – 136.
Кислотним числом (КЧ) називається показник, який характеризує кількість вільних жирних кислот в жирі. Кислотне число виражається в міліграмах калій гідроксиду, витраченого на нейтралізацію вільних жирних кислот, які містяться в 1 г жиру. По значенню кислотного числа, можна визначити якість жиру.
Хімічні властивості
Характерні реакції естерів, але мають певні особливості.
1. Гідроліз, або омилення – найважливіша реакція, яка відбувається під впливом кислот, лугів, ферментів.
а) омилення лугами:
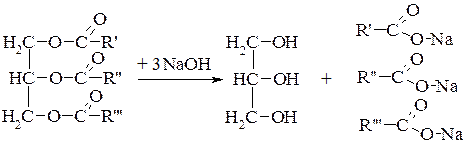
Жир Гліцерин Мило
Солі лужних металів називають милами, внаслідок чого утворилися терміни «омилення» і «реакція омилення», що відповідають сучасному терміну «гідроліз».

Тверде мило Рідке мило
Коли лужний гідроліз жирів потрібно прискорити, його проводять в спиртовому розчині, а не у воді.
б) омилення водою:

Жир Гліцерин Кислоти
Продуктами омилення водою, є вільні жирні кислоти (не розчинні у воді) та гліцерин.
У тваринних і рослинних організмах гідроліз жирів відбувається під дією ферменту – ліпази. Продукти гідролізу всмоктуються у вигляді вищих жирних кислот та гліцерину. Жири – енергетично дуже цінні продукти харчування. Загалом жири вважаються висококалорійними продуктами, зловживати якими недоцільно. При засвоєнні 1 г жиру виділяється 38,8кДж (9,3кКал). За рахунок жирів забезпечується 25 – 35% добової потреби людини в енергії. Рекомендована норма жиру в раціоні людини 90 – 107 г на добу. Недостатність жирів у харчуванні або систематичне використання продуктів зі зниженим вмістом жирів приводить до порушення роботи нервової системи, зниження імунітету. Проте надлишкове вживання жирів теж небажане – викликає ожиріння, виникають серцево-судинні захворювання.
Для омилення жирів в промисловості використовують насіння рицини, яке містить багато ліпази.
Гідролітичний розпад жирів та олій, ліпідів зерна та продуктів його переробки, м'яса, риби є однією з причин погіршення їх якості та псування. Цей процес прискорюється із збільшенням вологості продуктів, що зберігаються, підвищенням температури, активності ферменту ліпази. Гідроліз відбувається у багатьох технологічних процесах та під час кулінарної обробки продуктів (під час варіння та жарки). Продукт гідролізу – гліцерин перетворюється на шкідливий для здоров'я людини акролеїн в результаті дегідратації:
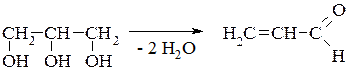
Акролеїн
Акролеїн має різкий неприємний запах, викликає сльозовиділення.
Кількість вільних жирних кислот, які містяться у продуктах і утворюються при гідролізі жирів, визначається кислотним числом.
2. Переестерифікація
Гліцериди за наявності каталізаторів (луги, метилат натрію, етилат натрію, натрій, калій) здатні обмінюватися ацилами як міжмолекулярно так і внутрішньомолекулярно.
Реакція міжмолекулярної переестерифікації:

Реакція внутрішньомолекулярної переестерифікації:

Переестерифікація приводить до зміни фізико-хімічних властивостей жирів і олій і дозволяє одержувати жири з необхідними для харчової технології властивостями без зміни їх жирнокислотного складу. Переестерифіковані жири використовуються в харчовій промисловості для одержання аналогів молочного жиру, кондитерського жиру, комбінованих жирів або продуктів з заданими властивостями.
3. Алкоголіз
Гліцериди під час нагрівання зі спиртами за наявності каталізаторів (луги, алкоголяти лужних металів, сульфатна кислота) утворюють естери відповідної кислоти і спирту. При цьому вивільнюється гліцерин. Такий обмін спиртів у естерах називають алкоголізом.
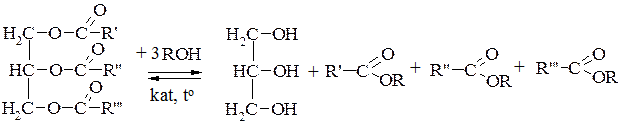
Жир Гліцерин Кислоти
Зі збільшенням молекулярної маси спирту алкоголіз уповільнюється. Наприклад, для соняшникової олії з використанням етилового спирту (С2Н5ОН) перебіг процесу алкоголізу досягає 35,3%, а з використанням амілового спирту (С5Н11ОН) – 11,5%. Положення рівноваги можливо здвинути зі зміною співвідношення тригліцеридів і спирту (використання надлишків), або виведенням із зони реакції одного із продуктів (наприклад, гліцерину) реакції.
4. Ацидоліз
Під час нагрівання до 250 – 300°С тригліцеридів з жирними кислотами за наявністю каталізаторів (сульфатна кислота, бор трифлуорид) відбувається обмін ацилів (R1 на R):

Алкоголіз і ацидоліз – окремі випадки реакції переестерифікації. Ці реакції зумовлені наявністю в молекулах гліцеридів естерних груп.
5. Гідрогенізація жирів
Не менш важливі для практики реакції, які відбуваються з перетворенням вуглеводневих залишків. До таких реакцій належать реакції гідрогенізації (або гідрування) гліцеридів. Гідрогенізація жирів – це процес приєднання водню до залишків ненасичених кислот, які входять до складу жирів, в результаті чого ці залишки переходять в залишки насичених кислот. А жири при цьому з рідких перетворюються на тверді. Вперше гідрогенізацію жирів здійснив С. Фокін у 1906 році. Найчастіше гідрують соняшникову, соєву, арахісову олії.
Гідрування приводить до зміни жирнокислотного складу жирів та олій і дозволяє одержати продукт із більшою температурою топлення, твердістю, стійкістю до окиснення, пластичністю.
Реакцію здійснюють воднем під час нагрівання до 180 – 240°С за наявності каталізаторів (подрібнений нікель). Змінюючи відповідно умови реакції, можливо здійснювати гідрування селективно, тобто гідру вати спочатку залишки ліноленової кислоти, потім лінолевої і, якщо треба – олеїнової кислоти.

1-Олеїноїл-2-лінолеїл-3-ліноленоїл Тристеароїл, три стеарин
(Рідкий жир) (Твердий жир)
Продукт реакції називається саломасою («штучним салом») і служить основою для виготовлення маргарину, інших харчових жирів, застосовується у виробництві мила. Для виготовлення маргарину саломасу емульгують у молоці, попередньо обробленому бактеріями Bacillus aidi levolactiti, які продукують молочну кислоту. Далі до утвореної емульсії додають для кольору каротин або яєчний жовток, для запаху вершкового масла – бутандіон, для запобігання окисненню – антиоксиданти на зразок 2- трет -бутил-4-метоксифенолу, лецитин (природний ПАР), сіль, цукор, вітаміни D тощо.
При неповному гідруванні отриманий саломас застосовується для виготовлення м'яких сортів маргарину.
Необхідно зауважити, що існує думка про певну шкідливість гідрованих рослинних олій для людини. Систематичне вживання таких жирів та продуктів на їхній основі (печиво – до 30 – 50% транс -ізомерів, картопля фрі – близько 40%, чіпси – 30% тощо) збільшують ризик ішемічних захворювань на серце, мозок; сприяють іншим видам атеросклерозу. Це пов'язують з появою в таких оліях (жирах) транс -карбонових кислот. Останні виникають в жорстких умовах процесу гідрування внаслідок ізомеризації цис -конфігурації, яка здебільшого притаманна природним ненасиченим кислотам. Кількість транс -карбонових кислот у кінцевому продукті може досягати 15 – 20% від суміші всіх ВКК.
6. Окиснення жирів
Під впливом світла і кисню повітря, а також при дії води у жирів з’являється неприємний смак і запах. Цей процес окиснення і часткового гідролізу називають згірклістю жирів. Ненасичені кислоти окиснюються в місці подвійних зв'язків, утворюючи пероксидні сполуки. Надалі відбувається розрив карбонового ланцюга за місцем подвійного зв'язку, у результаті чого утворюються альдегіди і кислоти з коротким ланцюгом, типу масляної кислоти з неприємним запахом. Ці продукти перетворень надають жиру гіркого присмаку.
Механізм окиснення жирів, розкритий М. Семьоновим, оснований на пероксидній теорії Баха і Енглера. На першій стадії окиснюється переважно група –СН2–, яка розташована в α-положенні відносно подвійного зв'язку. В результаті гемолітичного розриву зв'язку між Гідрогеном і Карбоном в α-положенні утворюється радикал, який при взаємодії з киснем повітря утворює пероксидний радикал. Після взаємодії цього радикалу з новою молекулою жиру утворюються гідро пероксид і новий радикал.
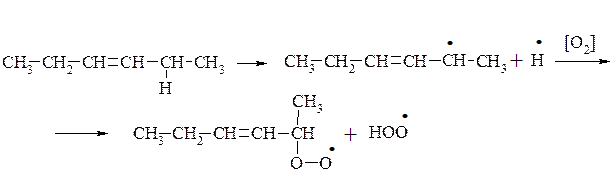
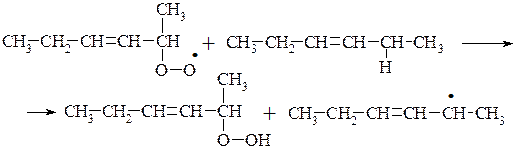
Первинні продукти окиснення жирів – гідропероксиди. Це нестійкі сполуки, вони перетворюються на вторинні продукти окиснення жирів –епоксисполуки, кетони, альдегіди, спирти та їх похідні. Під час утворення вторинних продуктів окиснення може відбуватися розрив карбонового ланцюга.
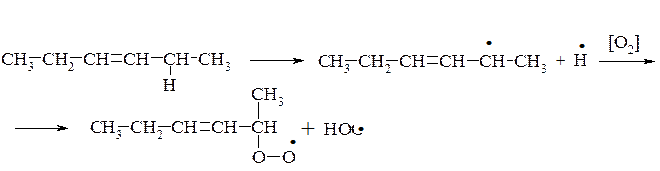


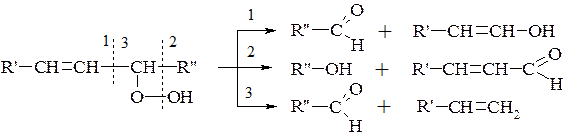
В результаті полімеризації та поліконденсації продуктів окиснення відбувається так зване «зшивання» молекул і обрив ланцюга, що приводить до утворення низькомолекулярних сполук.
Швидкість реакції окиснення зростає зі збільшенням: ступеня ненасиченості ВКК, які входять до складу жиру; рівня вологості; температури та вмісту кисню; присутності іонів металів (заліза, марганцю, міді). Надзвичайно великий вплив на швидкість окиснення має присутність антиоксидантів – речовин, що утворюють з вільними радикалами стабільні сполуки. До природних антиоксидантів відносяться токофероли, сполуки фенольної природи – кварцетин. Активність антиоксидантів зростає в присутності їх синергістів, зокрема, лимонної та аскорбінової кислот, лецитину.
В тваринному організмі кислоти жирів окиснюються до диоксиду вуглецю і води. На сьогодні відомі всі проміжні стадії цього складного процесу. Окиснення починається з –СН2– групи, що знаходиться в β-положенні відносно карбоксильної групи (–СООН). β-кетокислота, яка при цьому утворюється, розкладається в результаті гідролізу з утворенням нової кислоти і оцтової кислоти.
RCH2CH2COOH → R-COCH2COOH + H2O → R-COOH + CH3COOH
Щойно утворена кислота підлягає подібному окисненню до тих пір, поки не утвориться ацетооцтова кислота СН3СОСН2СООН. Остання окиснюється в тканинах (головним чином в м'язах) до СО2 і H2O.
До простих ліпідів відносяться воски – жироподібні аморфні речовини з температурою топлення 36 – 90 оС. За хімічною природою це естери вищих карбонових кислот і вищих спиртів, які здебільшого мають парну кількість атомів Карбону (табл.3). Крім згаданих естерів, у воску містяться вільні ВКК і ВС, алкани та інші домішки. Завдяки тому, що до складу восків входять головним чином насичені ВКК і спирти, воски в хімічному відношенні достатньо інертні речовини і важко окиснюються киснем повітря. Воски важко гідролізуються.
Таблиця 3. Вищі спирти
| Формула | Тривіальна назва |
| Насичені | |
| СН3–(СН2)10 -СН2ОН | Лауриловий |
| СН3-(СН2)12 -СН2ОН | Міристиловий |
| СН3-(СН2)14 -СН2ОН | Цетиловий |
| СН3-(СН2)16 -СН2ОН | Стеариловий |
| СН3-(СН2)22 -СН2ОН | Карнаубіловий |
| СН3-(СН2)24 -СН2ОН | Цериловий |
| СН3-(СН2)26 -СН2ОН | Монтановий |
| СН3-(СН2)28 -СН2ОН | Мірициловий |
| Ненасичені | |
| СН3-(СН2)7 -СН=СН-(СН2)7-СН2ОН | Олеїловий |
Більшість восків – тверді, пружньопластичні, інколи за кімнатної температури навіть крихкі речовини. Тільки деякі воски мають за кімнатної температури рідку консистенцію. Воски широко розповсюджені у природі. У рослин вони вкривають тонким шаром листя, стеблі, плоди і оберігають їх від змочування водою, висихання та дії мікроорганізмів. Бджолиний віск оберігає мед, личинок бджіл. Ланолін – тваринний віск – оберігає волосся і шкіру від дії води. У фітопланктону воски виконують функцію клітинного палива.
За походженням воски поділяють на тваринні (бджолиний, ланолін, спермацет), рослинні (карнаубський, лляний) і викопні (монтанний).
Тваринні воски
Це бджолиний, який виділяють своїми залозами бджоли; вовняний, який накопичується в відносно великих кількостях в вовні овець; спермацетове масло і спермацет, який в свою чергу міститься в полостях черепної коробки кашалота.
Бджолиний віск містить до 72% естерів здебільшого церилового та мірицилового спиртів пальмітинової, церотинової, меліси нової кислот, з яких мірицилпальмітат С15Н31СООС30Н61 складає 33%, вільних ВКК – 13%, алканів до 12%. Температура топлення становить 62 – 70оС, ЧО = 85 – 107; КЧ = 18 – 22. Віск важко гідролізується спиртовим розчином КОН. Бджолиний віск застосовується як компонент полірувальних засобів та лікарських препаратів.
Ланолін (від грецьк. lana – вовна, oleum – олія) добувають з жиропоту овець (на овечій вовні вміст такого воску досягає 25%). Це світло-жовта речовина зі слабким специфічним запахом, температура топлення становить 36 – 42оС. За хімічним складом це суміш естерів цетилового, церилового спиртів, а також, на відміну від інших восків, холестерину та його гідроксипохідних, з міристиновою, пальмітиновою, церотиновою кислотами. Характерним для ланоліну є вміст церотино-церилового естеру С25Н51СООС26Н53.

Холестерин
Ланолін стійкий до окиснення, на відміну від інших восків утворює стійкі водні емульсії. Завдяки цьому його використовують як мазеву та кремову основу, до якої вводять водорозчинні лікарські препарати.
Спермацет (від грецьк. sperma – сім'я, ketos – морська тварина) міститься в черепній порожнині (спермацетовому мішку) кашалота. Він на 98% складається з цетилпальмітату С15Н31СООС16Н33 (цетиловий естер пальмітинової кислоти). Температура топлення становить 45 – 54оС. Запах специфічний, дещо нагадує запах ворвані. Використовують як кремову та мазеву основу у парфумерії, як фармацевтичні препарати для лікування хронічних виразок.
Рослинні воски
Карнаубський віск покриває листя бразильської воскової пальми Copernicia cerifera. Він містить до 80% естери мірицилового спирту з карнаубовою С23Н47СООН і церотиновою кислотами; інших естерів ВКК С16 – С28 і ВС С30 – С32; вільних ВС (переважно монтанового). Карнаубський віск – тверда, крихка маса, яку можна розтерти в порошок. Колір її від сіровато-жовтого до зеленувато-жовтого. Температура топлення становить 83 – 91оС. Використовують у кондитерській промисловості для надання глянцю шоколадним та цукровим драже.
Лляний віск, який покриває стеблини льону, містить приблизно 35% естерів церилового спирту з олеїновою, ліноленовою, пальмітиновою і стеариновою кислотами.
Викопні воски
Крім тваринних і рослинних восків, відомий також монтановий (буровугільний) віск – мінеральний викопний продукт. Його виділяють із бурого вугілля (або з торфу) екстракцією бензином або бензино-бензеновою сумішшю при нагріванні. Такий неочищений віск складається приблизно із власне монтанового воску 70%, смоли 20% і асфальтенів 10%. Хімічний склад є сумішшю вільних ВКК (С24 – С30) головним чином монтанової, їхніх естерів з ВС (С24 – С30), вільних ВС, алканів тощо. З метою очищення сирого монтанового воску проводять його знесмолення. Монтанового віск з температура топлення 77 – 87оС широко використовується як мастила, полірувальні пасти і креми.
До складних ліпідів відносяться речовини, молекули яких крім залишків жирних кислот і спиртів містять також похідні ортофосфатної кислоти (фосфоліпіди), залишки вуглеводів (гліколіпіди), азотисті сполуки – холін, коламін, серін. Складні ліпіди містяться майже у всіх тканинах людського і тваринного організму, переважно у клітинних мембранах, особливо у мозкової і нервовій тканинах.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 9009; Нарушение авторских прав?; Мы поможем в написании вашей работы!