
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначення
|
|
|
|
Формула для обчислення величини рН (що не має одиниць розмірності) є наступною:
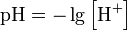
· рН абсолютно чистої води мусить мати значення 7. Всупереч поширеній думці, pH може змінюватися не тільки в інтервалі від 0 до 14, а може і виходити за ці межі. Наприклад, при концентрації іонів гідрогену [H+] = 10−15 моль/л, pH = 15, При концентрації іонів гідроксиду 10 моль/л pOH = −1.
Оскільки при 25 °C (стандартних умовах) [H+] В· [OH−] = 10−14, то зрозуміло, що при цій температурі pH + pOH = 14.
Оскільки в кислих розчинах [H+] > 10−7, то у кислих розчинів pH < 7, аналогічно, у лужних розчинів pH > 7, pH нейтральних розчинів дорівнює 7. При більш високих температурах константа електролітичної дисоціації води підвищується, відповідно збільшується іонний добуток води, тому нейтральною виявляється pH < 7 (що відповідає концентраціям, що збільшилися як H+, так і OH−); при зниженні температури, навпаки, нейтральна pH зростає.
35. Реакція обміну в розчинах електролітів. Йонно-молекулярні рівняння. Напрям зміщення йонних рівноваг.
Реакції обміну між розчинами електролітів. Йонні рівняння
Велика кількість хімічних реакцій проходить у розчинах. У таких реакціях обміну найчастіше беруть участь солі, кислоти, основи. Але чимало солей, кислот й основ у розчинах дисоціюють на йони, отже реакції в розчинах відбуваються не між молекулами, а між йонами. Такі реакції називають йонними.
Якщо хімічні реакції у водних розчинах електролітів відбуваються за участю йонів, то і хімічні рівняння, які відображають йонні реакції, слід записувати не лише в молекулярній, а й у йонній формі. Такі рівняння називають йонними рівняннями.
Для складання йонних рівнянь спочатку записують молекулярне рівняння реакції, наприклад:
NaOH + HCl = NaCl + H2O.
У другому рядку записуємо йонне рівняння. Для цього формули сильних електролітів потрібно записати в йонній формі. Для визначення сили електролітів можна користуватися таблицею розчинності, пам’ятаючи, що до сильних електролітів належать розчинні сполуки. Їхні формули записуємо в йонній формі. Вода є неелектролітом, тому її записуємо в молекулярній формі:
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O.
Таке рівняння називається повним йонним рівнянням.
У лівій і правій частинах йонного рівняння є однакові йони Na+(натрій-плюс) і Cl– (хлор-мінус). Ці йони можна видалити з лівої та правої частин йонного рівняння, оскільки вони не беруть участі в реакції. Скорочуємо в лівій і правій частинах рівняння катіони Натрію та аніони Хлору — й одержуємо скорочене йонне рівняння. У ньому записані тільки ті частинки, які реально взаємодіють у розчині:
OH- + H+ = H2O.
Реакції обміну в розчинах електролітів відбуватимуться до кінця, якщо один із продуктів реакції є неелектролітом. У цьому разі відбувається сполучення йонів, що утворюють неелектроліт, і вони виходять із сфери реакції. Це можливо, якщо в результаті реакції:
1) утворюється нерозчинна речовина (випадає осад),
2) виділяється газ,
3) утворюється вода або інший слабкий електроліт (Н2S, Н2СО3, Н2SО3).
Якщо виконується хоча б одна з цих умов, реакція відбувається до кінця і є незворотною. Якщо ж ці умови не виконуються, то при змішуванні розчинів утворюється суміш йонів і реакція є зворотною.
Для прогнозування можливості перебігу реакцій йонного обміну в розчинах електролітів слід використовувати таблицю розчинності.
36 Гідроліз солей.Залежність ступеня і константи гідролізу солі від її складу концентрації ітемператури розчина.
Гідроліз солі це обмінна реакція води і солі в результаті якої утворюється слабкі електроліти і як правило змінюється pH розчину.
Розрізняють оборотний і необоротний гідроліз солей:
· 1. Гідроліз солі слабкої кислоти і сильної основи (гідроліз за аніоном):
Na2CO3=2Na++CO32-
CO2−3+H2O=HCO−3+OH−
Na2CO3+Н2О=NaHCO3+NaOH
(Розчин має слаболужну середу, реакція протікає оборотно, гідроліз по другому щаблі протікає в незначній мірі)
· 2. Гідроліз солі сильної кислоти і слабкої основи (гідроліз за катіоном):
CuCl2=Cu2++2Cl-
Cu2++Н2О=CuOH++Н+
CuCl2+Н2О=CuOHCl+HCl
(Розчин має слабокислую середу, реакція протікає оборотно, гідроліз по другому щаблі протікає в незначній мірі)
· 3. Гідроліз солі слабкої кислоти і слабкої основи:
Al2S3=2Al3++32-
2Al3++3S2−+6Н2О=2Al(OH)3(осад)+3H2S(газ)
Al2S3+6H2O=2Al(OH)3+3H2S
Nа2СО3 + HOH =>NаНСО3 + NаОН
СО32- + 2Na+ + H+ + OH- =>НСО3- + ОН- + 2Na+
(Рівновага зміщена в бік продуктів, гідроліз протікає практично повністю, тому що обидва продукти реакції йдуть із зони реакції у вигляді осаду чи газу).
Сіль сильної кислоти і сильної основи не піддається гідролізу, і розчин нейтральний.
Кількісно гідроліз солей характеризується величинами ступеня та константи гідролізу.
Ступенем гідролізу солі називається відношення молярної концентрації гідролізованої солі до загальної молярної концентрації солі в розчині.
λг=Сгідр/С0
λг- тим більша чим
1.Менша концентрація розчину солі
2.більша температура розкину(Кд зростає
3.чим слабкішим є електроліт який утворює сіль.
Чим слабкіший електроліт який утворює сіль тим більше в мірі вона гідролізована.
Кд гідролізу солі = відношенню іонного добутку води до Кд слабкого електроліту.
37. Поняття про електрод електродний потенціал. Ряд стандартних електродних потенціалів.
Електрод - метал занурений в розчин електроліту.
Під дією полярних молекул води частина поверхневих атомів металу переходить в розчин у вигляді катіонів залишивши свої валентні електрони в металі.
Катіони в розчині утримуються біля поверхні негативно зарядженого металу в результаті на поверхні поділу метал –розчин утворюється подвійней електричний шар різниця потенціалів між поверхнею металу і притягаючим до неї шаром катіонів металу називається електродним потенціалом металу.
Електродний потенціал — різниця електричних потенціалів між електродом та електролітом, в контакті з яким він знаходиться (найчастіше всього між металом і розчином електроліту).
Якщо пластинку будь-якого металу, наприклад, цинку занурити у воду, то іони цинку, що утворюють кристалічну решітку металу, під дією полярних молекул води гідратуються, зв'язок їх з решіткою послаблюється, і деяка їх кількість, відриваючись від металу, перейде у воду, а на металі залишиться еквівалентна кількість електронів:
Zn = Zn2+ + 2e-
Між катіонами металу, що перейшли у воду, і негативно зарядженою пластинкою виникає електростатичне притягання, яке зумовлює зворотний процес — перехід іонів металу на пластинку; в системі встановлюється хімічна рівновага.
У випадку малоактивного металу на поверхні металу абсорбується його катіони заряджаючи її позитивно. Таким чином значення і знак електронного потенціалу залежить від природи учасників електродного процесу та їх концентрації. Кількісно ця залежність виражається рівнянням Нерста
γмеn+/me0 =γ0men+/me0+RT/Nf*(lnCmen+)
Стандартні електродні потенціали металів визначають відносно стандартного водневого електрода потенціал якого прийнято вважати 0
Стандартний водневий електрод представляє собою пластинову пластинку покриту пористою платиною занурену в одномолярний розчин сульфатної кислоти через яку за стадартних умов пропускається водень.
При цьому в системі утворюється напрямлений потік електронів тобто електричний струм. Напруга цього струму = абсолютному значенню металевого електрода.
Потенціалом металевого електрода зануреного в одномолярний розчин його солі виміряно при температурі 25 0С стосовностандартного водневого електрода. Називається стандартним електродним потенціалом метала.
Метали розташовані в ряд у порядку зростання напруги називається електрохімічним рядом наприг металів.
38. Корозія металів.Хімічна електрохімічна корозія. Методи захисту металічних споруд від корозії.
Коро́зія металів — процес хімічного руйнування металів і сплавів при їх взаємодії з зовнішнім середовищем: повітрям, водою, розчинами електролітів тощо. Розрізняють два види корозії: хімічну і електрохімічну.Руйнування металів внаслідок окиснення при взаємодії їх з навколишнім середовищем.
Види корозії за характером руйнувань.
1.суцільна
2.місцева
3.підповерхнева.
4.між кристалічна.
5.селективна.
Хімічна корозія -окиснення металу компонентами навколишнього середовища без виникнення в системі електро струму.
Хімічна корозія відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів (спирту, бензину, мінеральних масел тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню і ін.) при високій температурі (так звана газова корозія).
У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів і т. д. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється. Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.
Електрохімічна корозія більш поширена і завдає значно більшої шкоди, ніж хімічна. Вона виникає при контакті двох металів у середовищі водних розчинів електролітів. На відміну від хімічної електрохімічна корозія супроводжується переміщенням валентних електронів з одної ділянки металу на іншу, тобто виникненням місцевих електричних струмів внаслідок утворення на кородуючій поверхні так званих гальванічних пар.
Для кращого розуміння механізму електрохімічної корозії розглянемо докладніше процес розчинення металу в розчині електроліту з виділенням водню, наприклад розчинення цинкової пластинки в розведеній сульфатній кислоті без контакту і в контакті з мідною пластинкою.
Контактна корозія відбувається коли в електролітичному середовищі перебувають в контакті різні метали.
Атмосферна корозія в вологій атмосфері метали окислюються киснем розчиненим в водяній плівці яка утворюється внаслідок конденсації води на поверхні металу.
Методи захищення від корозії
1.Застосування хімічно стійких сплавів.
2. ізоляція поверхні металів від агресивного середовища шляхом нанесення неметалічних та металічних покрить.
Неметалічні покриття емалі фарби смоли полімерні плівки
Пасивація –глибоке гальмування корозії металу внаслідок утворення на його поверхні захисної оксидної гідроксидної оба сольової плівки
Металічні покриття можуть бути анодними
ікатодними
Анодний -покриття металевого виробу більшактивним металом.
Катодний -покриття металу захисним шаром менш активним захищає при відсутності механічного порушення цілісності покриття.
Заміна агресивного середовища застосування інгибритів корозії.
Інгібриторами корозії -називають речовини невеликі добавки яких до корозійного середовища сповільнюють корозію металів.для інгибриторів полян=гає в тому що на поверхні металу вони утворюють абсорбційну плівку яка ізолює метал від середовища.
Електрохімічний-протектроний та катодний
Суть протекторного захистуи полягає в тому що до об’єкта захисту провідником підєднують протектор лист із більш активного металу.
Врезультаті утворюється гальванічна пара в якій металева конструкція буде катодом а окислюватися буде протектор вони захищають об’єкти від корозії на відстанні 50 м.
При катодному захисті об’єкт сполучають провідником з негативним полюсом джерела постійного струму а позитивний полюс заземлюють або сполучають з шматком металобрухту захищає на відстані 2 км.
39. Поняття про електроліз та його застосування. Закон Фарадея.Акумулятори.
Електроліз -це сукупність фізико-хімічних процесів які відбуваються при проходженні постійного електричного струму через розчин або розплав електролітів.
При електролізі електрична енергія зовнішнього джерела струму перетворюється в хімічну ОВР які відбуваються при електролізі залежать ві складу електроліту.
Інертним називають анод матеріал якого неокиснюється під час електролізу.
Потенціалом розкладу називається мінімальна напруга струму необхідна для початку електролізу цієї речовини.
Застосування електролізу.
1.Для виробництва активних металів та неметалів електролізу розплавів та інших сполук серед них найважливіше виробництво сполук та сполук які не можна отримати іншим способом.
2. для виробництва простих і складних речовин електролізом розчинів.
3. гальвано-пластика відтворення точних копій рельєфних об’єктів електроосадженням металів.
4.електрохімічні перетворення порверхні металічних виробів для підвищення міцності термостійкості і захисту від корозії.
5.Зарядження акумуляторів.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 737; Нарушение авторских прав?; Мы поможем в написании вашей работы!